铝的化学性质 知识点题库
取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是
A . 1:1
B . 1:2
C . 1:3
D . 3:2
铝矾石(主要成分是Al2O3 , 还含有少量杂质SiO2、Fe2O3)是工业上用于炼铝的主要矿物之一,由铝矾石制取金属铝的工艺流程图如下:
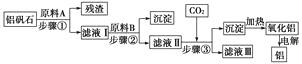
请回答下列有关问题:

请回答下列有关问题:
-
(1) 下列有关铝矾石以及用铝矾石炼铝的说法中,不正确的是( )A . 铝矾石中只含有金属氧化物 B . 铝矾石与河沙含有相同的成分 C . 铝矾石炼铝需要消耗电能 D . 铝矾石炼铝的过程中不涉及置换反应
-
(2) 原料A的名称是,步骤①用到的主要玻璃仪器有。
-
(3) 滤液Ⅰ中要加入稍过量的原料B,原料B的化学式是,步骤②反应的离子方程式为。
-
(4) 在步骤③中(填“能”或“不能”)用盐酸代替CO2 , 原因是。
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱.但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+ . 回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示).
(2)写出锌和氢氧化钠溶液反应的化学方程式 .
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 .
①硫酸铝和氢氧化钠 ②硫酸铝和氨水③硫酸锌和氢氧化钠④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式 .试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 .
下列有关说法正确的是()
A . 电离、电解、电镀、电化学腐蚀都需要通电后才能实现
B . 可用pH试纸测定新制氯水的pH
C . 水是一种极弱的电解质,纯水在任何情况下都显中性
D . 空气中,金属铝的表面会迅速形成一层致密的氧化物保护膜,这是铝发生了吸氧腐蚀
E . 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)>Ksp(CuS)
F . 在配制硫酸铁溶液时,为了防止发生水解,可以加入少量的稀盐酸
完成下列反应的反应方程式:
-
(1) NaOH溶液吸收氯气的反应:
-
(2) 铁与水蒸气在高温下的反应:
-
(3) 氢氧化铁溶于盐酸:
-
(4) 铝单质溶解在氢氧化钠溶液中:
-
(5) 过氧化钠与二氧化碳反应:.
下列叙述正确的是( )
A . 铝制槽车可用来贮运浓硫酸、浓硝酸是因为常温下铝和浓硫酸、浓硝酸不反应
B . 两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多
C . 合金的熔点一般比组成它的各成分的熔点都高
D . 工业上常利用铝热反应冶炼难熔金属,如钒、铬、锰
下列元素在自然界中仅以化合态存在的是( )
①Si ②Al ③Cl ④Fe ⑤Na.
A . ①②⑤
B . ①②
C . ①②③
D . ①②③④⑤
将黄豆粒大小的金属钠置于一铝片上,在铝片上用酒精灯加热至钠充分燃烧,移去酒精灯后,在铝片上有淡黄色粉末生成.过一段时间后,铝片上的淡黄色粉末变成带有白色泡沫的潮湿液体.以下有关该实验的叙述错误的是( )
A . 上述实验过程中的变化都是氧化还原反应
B . 上述实验过程中产生的泡沫里存在混合气体
C . 上述实验过程中还存在反应:Al2O3+2NaOH═2NaAlO2+H2O
D . 上述实验过程中还存在反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑
对Al、Fe二种金属元素,下列说法正确的是( )
A . 铝能够稳定存在于空气中,而铁很容易生锈,说明铁比铝活泼
B . 等物质的量的Al、Fe分别与足量盐酸反应放出等质量的H2
C . 二者的氢氧化物都不可以通过氧化物化合反应直接制备
D . 二者的单质都能与强碱溶液反应生成H2
下列说法正确的是( )
A . 可用品红溶液检验SO2
B . 常温下,可用铝罐贮运稀硝酸
C . NaOH溶液可长期贮存在带玻璃塞的试剂瓶中
D . 常温常压下,22.4LN2含有氮原子数为2×6.02×1023
有些物质既能与强酸溶液反应又能与强碱溶液反应,下列物质不具有此类性质的是( )
A . NaHCO3
B . (NH4)2CO3
C . Al
D . AlCl3
下列变化不可能通过一步实验直接完成的是()
A . Al(OH)3 → Al2O3
B . Al2O3 → Al(OH)3
C . Al → AlO2-
D . Al3+ → Al(OH)3
某同学通过系统实验探究铝及其化合物的性质,操作符合题意且能达到目的的是( )
A . 向氯化铝溶液中滴加过氨水,最终得到澄清溶液
B . 等质量的铝分别与足量的盐酸和氢氧化钠溶液反应制得等质量的氢气
C . 常温下铝与浓硝酸反应制得大量的NO2
D . AlCl3溶液加热蒸干得到无水氯化铝晶体
某无色溶液能与铝作用生成氢气,则溶液中可能大量共存的离子组是( )
A . H+、Ba2+、Mg2+、Cl-
B . Cl-、CO32-、Cu2+、Mg2+
C . NO3-、SO42-、K+、Al3+
D . NO3-、OH-、Mg2+、Cl-
在托盘天平的两盘,放上质量相等的A、B两烧杯,调至平衡,然后分别倒入质量相等的足量盐酸,继而在AB两烧杯中放入下述各组物质,结果天平仍保持平衡的是( )
A . 0.5 mol Na和0.5 mol Al
B . 0.1 mol Zn和0.1 mol Al
C . 8.4 g MgCO3和8.4 g NaHCO3
D . 10 g CaCO3 和10 g Na2CO3
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。
-
(1) 铝原子核外有种不同运动状态的电子,最外层电子的轨道表示式为。
-
(2) 铍与铝性质相似。将BeCl2溶液加热蒸干后灼烧,再使其熔融,用直流电电解,可得到单质铍和一种单质气体,则该气体的分子式为。写出BeCl2溶液和过量氨水反应的离子方程式:。
-
(3) 取适量Al-Mg合金样品置于烧杯中,加入20mL1mol/L的NaOH溶液,恰好完全反应。下列叙述正确的是。
a.上述反应可视为原电池反应,此时Mg作负极,Al作正极
b.若加入的是20mL1mol/L的盐酸,则放出的氢气的物质的量减少

c.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2
-
(4) 用铝和金属氧化物反应制备单质是工业上较常用的方法。如:2Al+4BaO
 3Ba↑+BaO•Al2O3。常温下Al的金属性比Ba的金属性(选填“强”、“弱”)。利用上述方法可制取Ba的主要原因是。
3Ba↑+BaO•Al2O3。常温下Al的金属性比Ba的金属性(选填“强”、“弱”)。利用上述方法可制取Ba的主要原因是。 a.高温时,Al的活泼性大于Ba
b.高温有利于BaO分解
c.高温时,BaO∙Al2O3比Al2O3稳定
d.Ba的沸点比Al的低
-
(5) 氮化铝是一种既有前途的电子绝缘基片材料,它化学稳定性好,耐高温、酸、碱,抗冲击能力强。可通过下列反应制备:Al2O3+3C+N2→2AlN+3CO+Q(Q<0)。上述反应物与生成物中,属于非极性分子的电子式为;构成AlN的微粒是。
-
(6) 下列选项能判断氮、氧元素非金属性强弱的是。
a.气态氢化物的沸点
b.单质与氢气化合的难易程度
c.最高价氧化物对应水化物的酸性
d.NO中O显-2价,N显+2价
下列关于铝及其氧化物与强碱溶液反应的说法中,正确的是( )
A . 都有H2O生成
B . 都有H2生成
C . 反应后铝元素主要以AlO2-的形式存在
D . 反应后铝元素主要以Al3+的形式存在
对实验I~IV的实验现象判断正确的是( )
A . 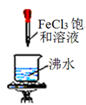 :产生红褐色沉淀
B .
:产生红褐色沉淀
B . 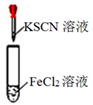 :溶液变红色
C .
:溶液变红色
C .  :产生大量气泡
D .
:产生大量气泡
D .  :试管中先出现白色沉淀,后溶解
:试管中先出现白色沉淀,后溶解
 :产生红褐色沉淀
B .
:产生红褐色沉淀
B .  :溶液变红色
C .
:溶液变红色
C .  :产生大量气泡
D .
:产生大量气泡
D .  :试管中先出现白色沉淀,后溶解
:试管中先出现白色沉淀,后溶解
称取两份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱。若同温同压下放出相同体积的气体,则两份铝粉的质量比为( )
A . 1:1
B . 1:3
C . 2:3
D . 1:6
常温下能用铝制容器盛放的是( )
A . 浓盐酸
B . 浓硝酸
C . 稀硫酸
D . 稀硝酸
最近更新



