铝的化学性质 知识点题库
将amol钠和amol铝一同投入mg足量水中,所得溶液密度为dg·mL-1 , 该溶液中溶质质量分数为( )
A . 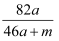 %
B .
%
B . 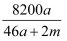 %
C .
%
C . 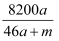 %
D .
%
D . 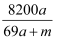 %
%
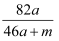 %
B .
%
B . 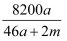 %
C .
%
C . 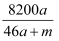 %
D .
%
D . 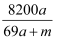 %
%
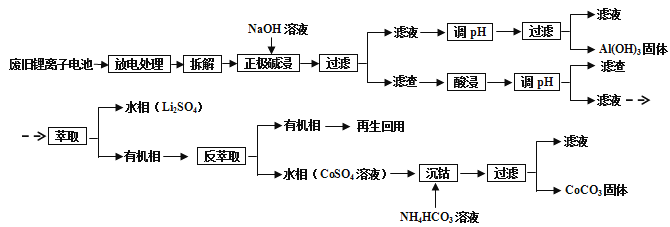
锂离子电池的应用很广,其正极材料可再生利用.某离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等.充电时,该锂离子电池负极发生的反应为6C+xLi++xe﹣═LixC6 . 现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出).
-
(1) LiCoO2中,Co元素的化合价为
-
(2) 写出“正极碱浸”中发生反应的离子方程式
-
(3) “酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 可用盐酸代替H2SO4和H2O2的混合液,但缺点是
-
(4) 写出“沉钴”过程中发生反应的化学方程式
-
(5) 充放电过程中,发生LiCoO2与Li1﹣xCoO2之间的转化,写出放电时电池反应方程式
金属铝在酸性或碱性溶液中均可与NO3﹣发生氧化还原反应,转化关系如下:

已知,气体D的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,气体D和F反应可生成盐.气体D和A溶液反应生成白色沉淀.气体C为无色气体,气体E为红棕色气体.B溶液加入过量的F溶液能生成A溶液.
请回答下列问题:
-
(1) C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质为.
-
(2) 完成并配平下列离子方程式: Al+NO3﹣+H+→ Al3+++H2O.
-
(3) D→C反应的化学方程式是.
-
(4) 除去气体C中的杂质气体E的化学方法:(用化学方程式表示).
将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为amol•L﹣1的HCl溶液,过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L.将溶液蒸干并充分灼烧得到固体W2g.下列关系式中错误的是( )
A . 24n(Al)+35.5n(Na)=W2﹣W1
B . n(Na)+3n(Al)=aV2
C . n(Na)+3n(Al)=  D . aV2=
D . aV2= 
 D . aV2=
D . aV2= 
取四等份铝,分别加入足量的下列溶液中,充分反应后,放出氢气最多的是( )
A . 3 mol•L﹣1氨水
B . 4 mol•L﹣1 HNO3
C . 8 mol•L﹣1 NaOH
D . 18 mol•L﹣1 H2SO4
下列说法正确的是( )
A . 绿色食品是不含任何化学物质的食品
B . 灼烧某物质时,用眼直接观察到火焰呈黄色,则可判断该物质不含钾元素
C . 向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀
D . 称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液,则放出氢气的体积(同温同压下)不相等
下列物质间的反应肯定无明显实验现象的是( )
A . 加热经SO2漂白的品红试液
B . 将少量SO2通入NaOH溶液中
C . 将新制的氯水在阳光下照射
D . 将打磨的铝片加入浓NaOH溶液中一段时间
下列关于铝单质的叙述中正确的是( )
A . 由于铝在空气中不会锈蚀,所以铝制品的使用寿命都很长
B . 由于铝具有强还原性,所以常用铝来冶炼某些高熔点金属
C . 常温下,铝被浓硫酸钝化,所以可用浓硫酸除去铝表面的铜镀层
D . 由于铝的导电性比铜强,所以常用铝制造电线、电缆
-
(1) 我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料。请用离子方程式来证明它是一种两性氧化物:、.
-
(2) 取等质量的两份某镁铝合金分别加入足量的稀盐酸和氢氧化钠溶液中,产生的标准状况下H2体积分别为33.6L、22.4L则该合金中镁,铝的物质的量之比为。
-
(3) Cl2O为国际公认高效安全灭菌消毒剂,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,补充完整并配平方程式:__Cl2+Na2CO3+= NaHCO3+NaCl+Cl2O。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
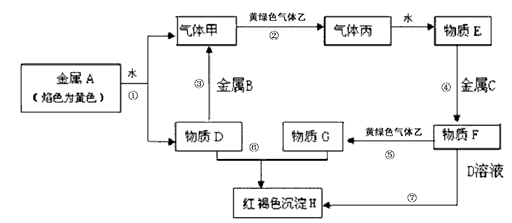
请根据以上信息回答下列问题:
-
(1) 写出下列物质的化学式:A: B: F: 丙:
-
(2) 说出黄绿色气体乙的一种用途:。
-
(3) 若除去F溶液中含有的少量G,需加入,实验室检验G中所含的金属离子时,常在G的溶液中加入溶液。
-
(4) 反应①的离子方程式为。
-
(5) 反应⑦涉及的化学方程式有。
下列元素在一定条件下,能实现“  ”直接转化的元素是
”直接转化的元素是
 ”直接转化的元素是
”直接转化的元素是
A .  B .
B . 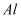 C .
C . 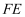 D .
D . 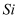
 B .
B . 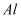 C .
C . 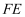 D .
D . 
下列事实不能用电化学理论解释的是()
A . 轮船水线以下的船壳上镶嵌有一定量的锌块
B . 镀锌的铁制品比镀锡的铁制品耐用
C . 铝片不用特殊方法保存
D . 生铁跟稀硫酸反应比纯铁的反应来得快
某古玩爱好者收藏的“商代铝碗”在“鉴宝”时被专家当场否定,其理由是( )
A . 铝的导热性较强,不易做碗
B . 铝的质地较软,易变形,不易做碗
C . 铝元素易导致老年痴呆,不易盛放食物
D . 铝的性质较活泼,难提炼,商代不可能有铝制品
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如右图所示的装置图:请回答下列问题:
![]()
-
(1) 写出Al和NaOH溶液反应的离子方程式。
-
(2) 在点燃H2之前必须先进行。

-
(3) 实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可教师说太危险,你认为产生危险的原因是。
-
(4) 实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97 g·mL-1、0.88 g·mL-1、1.00 g·mL-1,并据此对实验进行了改进。在改进后的实验中H2的生成速率。(填“减慢”或“加快”)
-
(5) 将4.6gNa和8.1gAl投入到足量的水中,所得溶液的体积为200mL,则生成标准状况下的H2的体积是?该溶液中溶质的物质的量浓度是?
下列有关铝元素的说法正确的是( )
A . 铝粉可与氧化镁粉在高温条件下发生铝热反应
B . 铝粉与稀硝酸能反应产生氢气
C . 实验室中通常将氢氧化钠溶液滴入氯化铝溶液制取氢氧化铝
D . 氯化铝溶液中不断滴入氨水的过程中会先生成白色沉淀
化学与生活密切相关。下列说法错误的是( )
A . 碳酸钠可用于去除餐具的油污
B . 漂白粉可用于生活用水的消毒
C . 铝餐具不易用来蒸煮或长时间存放酸性、碱性和咸的食物
D . 碳酸钡可用于胃肠X射线造影检查
下列现象或事实可用同一原理解释的是( )
A . 浓硫酸和浓盐酸长期暴露在空气中浓度降低
B . 铁在冷的浓硫酸中和铝在冷的浓硫酸中都没有明显变化
C . SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色
D . 漂白粉和亚硫酸钠长期暴露在空气中变质
关于下列实验的说法中正确的是( )
A . 实验室中通过加热氯化铵固体制取氨气
B . 在胆矾中加入浓硫酸后,胆矾由蓝色变为白色,说明浓硫酸具有吸水性
C . 常温下,可以用铝罐贮存浓硫酸和浓硝酸,说明铝与浓硫酸和浓硝酸不反应
D . 将  样品溶于稀硫酸,滴入
样品溶于稀硫酸,滴入 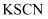 溶液,溶液变红,说明原样品已变质
溶液,溶液变红,说明原样品已变质
 样品溶于稀硫酸,滴入
样品溶于稀硫酸,滴入 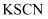 溶液,溶液变红,说明原样品已变质
溶液,溶液变红,说明原样品已变质
化学与生产、生活密切相关。下表中物质在生产、生活中的应用及解释均正确的是( )
| 选项 | 应用 | 解释 |
| A | 75%的酒精可用于皮肤消毒 | 酒精具有强氧化性 |
| B | KIO3应用于制加碘食盐 | KIO3可补充人体缺少的碘元素 |
| C | 高铁车厢采用铝合金材料 | 铝化学性质稳定,难与氧气反应 |
| D | 高纯硅作计算机芯片的材料 | 硅晶体在自然界中能稳定存在 |
A . A
B . B
C . C
D . D
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化、造纸工业上作施胶剂、食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO、Fe2O3)可制备明矾。工艺流程如下:

已知:SiO2是不溶于硫酸的固体
回答下列问题:
-
(1) Al2O3与稀硫酸反应(用离子方程表示)。
-
(2) 操作Ⅰ的名称是 ,滤渣Ⅰ的主要成分是。
-
(3) 检验滤液Ⅰ中是否存在Fe3+的方法是。
-
(4) 在滤液Ⅰ中加入高锰酸钾目的是,发生反应的离子方程式为(该条件下H+ 参与反应、Fe2+转化为Fe3+、MnO
 转化为Mn2+)。
转化为Mn2+)。
-
(5) 根据流程图推测加入沉淀剂的目的是,滤渣Ⅱ中主要含有(填化学式,只写一种即可)。
最近更新



