钠的氧化物 知识点题库
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | Na2O2能与二氧化碳、水反应放出O2 | Na2O2可用作呼吸面具的供氧剂 |
B | 铝比铁活泼 | 铝比铁更容易被腐蚀 |
C | 钠与水反应是放热反应 | 与水反应时,钠浮在水面上 |
D | 晶体硅熔点高硬度大 | 可用于制作半导体材料 |
A . A
B . B
C . C
D . D
可用于呼吸面具和潜水艇中作为氧气来源的物质是( )
A . CaCl2
B . Ca(OH)2
C . NaCl
D . Na2O2
下列关于钠的说法中,正确的是( )
A . 金属钠的熔点很高
B . 钠是一种银白色金属,硬度很大
C . 钠着火时,可用沙土灭火
D . 豆粒大的钠投入硫酸铜溶液中,生成铜和硫酸钠
化学中常用类比的方法可预测许多物质的性质.如根据H2+Cl2=2HCl推测:H2+Br2=2HBr.但类比是相对的,如根据2Na2O2+2CO2=Na2CO3+O2 , 类推2Na2O2+2SO2=Na2SO3+O2是不符合题意的,应该是Na2O2+SO2=Na2SO4 . 下列各组类比中正确的是()
A . 钠与水反应生成NaOH和H2 , 推测:所有金属与水反应都生成碱和H2
B . Na2CO3+2HCl=2NaCl+H2O+CO2↑,推测:Na2SO3+2HCl=2NaCl+H2O+SO2↑
C . CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
D . 铝和硫直接化合能得到Al2S3 , 推测:铁和硫直接化合也能得到Fe2S3
下列化学方程式中,不能正确表达反应颜色变化的是( )
A . 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4=Cu+ZnSO4
B . 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2=CaCO3↓+H2O
C . Na2O2在空气中放置后由淡黄色变为白色2Na2O2=2Na2O+O2↑
D . 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3=2Fe(OH)3+3MgCl2
下列关于氧化钠和过氧化钠的叙述正确的是( )
A . 将Na2O与Na2O2分别加入滴有酚酞的水中,二者现象相同
B . 在Na2O2与水的反应中,水是还原剂
C . 相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为1:1
D . 等质量的Na2O与Na2O2投入等量且足量水中充分反应后所得溶液物质的量浓度相等
在密闭容器中充入体积比为1∶1的CO2和CO的混合气体,这时测得容器内的压强为P1 , 若控制容器的体积不变,加入足量的Na2O2固体,不断用电火花燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为P2 , 则P1和P2之间的关系是( )
A . P1=8P2
B . P1=4P2
C . P1=2P2
D . P1=P2
如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。钠及其氧化物的物质的量 均为0.1 mol,水的质量为100 g。下列说法正确的是( )

A . 甲、乙、丙都属于氧化还原反应
B . 甲反应的离子方程式为Na+2H2O=Na++2OH-+H2↑
C . 丙充分反应,能产生0.05 mol O2 , 转移电子0.1 mol
D . 甲、乙、丙充分反应后所得溶液的质量分数分别为w1、w2、w3 , 则2w1=w2=w3
某溶液中含有NH4+、Na+、Mg2+、NO3-4种离子,若向其中加入少量过氧化钠固体后溶液中离子浓度基本保持不变的是( )
A . Mg2+
B . Na+
C . NH4+
D . NO3-
下列各组物质相互混合反应后,既有气体生成,最终又有沉淀生成的是( )
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中 ④足量Na2O2投入FeCl2溶液中
A . 只有①④
B . 只有③
C . 只有②③
D . 只有①③④
下列各组物质的转化关系中不能全部通过一步反应完成的是( )
A . Na→NaOH→Na2CO3→NaCl
B . Mg→MgCl2→Mg(OH)2→MgSO4
C . Al→Al2O3→Al(OH)3→NaAlO2
D . Fe→FeCl2→Fe(OH)2→Fe(OH)3
下列解释事实的方程式正确的是( )
A . CO2通入过量的NaOH溶液中:CO2+OH-=  B . SO2的催化氧化反应:2SO2+O2
B . SO2的催化氧化反应:2SO2+O2 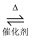 2SO3
C . 过氧化钠做呼吸面具的供氧剂:Na2O2+CO2=Na2CO3+O2
D . 氯气用于自来水消毒:Cl2+H2O⇌2H++Cl-+ClO-
2SO3
C . 过氧化钠做呼吸面具的供氧剂:Na2O2+CO2=Na2CO3+O2
D . 氯气用于自来水消毒:Cl2+H2O⇌2H++Cl-+ClO-
 B . SO2的催化氧化反应:2SO2+O2
B . SO2的催化氧化反应:2SO2+O2 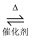 2SO3
C . 过氧化钠做呼吸面具的供氧剂:Na2O2+CO2=Na2CO3+O2
D . 氯气用于自来水消毒:Cl2+H2O⇌2H++Cl-+ClO-
2SO3
C . 过氧化钠做呼吸面具的供氧剂:Na2O2+CO2=Na2CO3+O2
D . 氯气用于自来水消毒:Cl2+H2O⇌2H++Cl-+ClO-
把3molNO2气体依次通过盛有①1L 1mol/L碳酸钠溶液;②浓硫酸;③足量的Na2O2装置后(假设每一步的反应都是充分的),再用排水法收集残留气体,则收集到的气体是( )
A . 1/3mol NO
B . 1molNO2和0.5mol O2
C . 0.25molO2
D . 1mol NO
钠及其化合物是重要的化学物质。回答下列问题:
-
(1) 少量的钠保存在中,如果露置在空气中会迅速变成(填化学式)。
-
(2) 钠很活泼,一定条件下,它能置换出TiCl4中Ti,写出该反应的化学方程式:。
-
(3) Na2O2属于(填物质类别),可用蒸馏水检验Na2O中混有少量Na2O2 , 试用化学方程式解释含有Na2O2的现象:。
-
(4) 热稳定性:NaHCO3(填“>”或“<”)Na2CO3 , 实验室可用如图装置验证,试管B中应装入的固体是。

-
(5) 1mL0.1mol·L-1NaHCO3溶液与1mL0.01mol·L-1Ca(OH)2溶液混合产生CaCO3白色沉淀。
①请用离子方程式表示生成CaCO3的反应过程:。
②同学们设计了如图实验方案,验证上述反应过程,请将方案补充完整:
实验步骤
实验现象
ⅰ.取1mL0.1mol
 L-1NaHCO3溶液,向其中加入1mL0.01mol
L-1NaHCO3溶液,向其中加入1mL0.01mol  L-1CaCl2溶液
L-1CaCl2溶液无明显现象
ⅱ.向上述溶液中滴加
将7.8g Na2O2投入水中充分反应,最终形成500ml溶液。求:
-
(1) Na2O2的物质的量?
-
(2) 反应后溶液中溶质的物质的量?
-
(3) 反应后溶液中溶质的物质的量浓度?
-
(4) 产生气体标况下的体积?
某溶液中含有HCO  、CO
、CO  、Na+、NO
、Na+、NO  离子。向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
离子。向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
 、CO
、CO  、Na+、NO
、Na+、NO  离子。向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
离子。向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是( )
A . NO  B . HCO
B . HCO  、NO
、NO  C . Na+、NO
C . Na+、NO  D . CO
D . CO  、NO
、NO  、Na+
、Na+
 B . HCO
B . HCO  、NO
、NO  C . Na+、NO
C . Na+、NO  D . CO
D . CO  、NO
、NO  、Na+
、Na+
化学与生产、生活、环境息息相关。从化学视角回答下列问题:
-
(1) 钠在空气中的燃烧产物A可用于呼吸面具或潜水艇中氧气的来源,涉及的主要反应的化学方程式为(写一种即可)。
-
(2) 家庭的厨卫管道内常因留有油脂、毛发、菜渣、纸棉纤维等而造成堵塞,此时可用固体管道疏通剂进行疏通。管道疏通剂主要成分为铝和氢氧化钠,疏通管道时发生反应的离子方程式是,必须注意的安全警示是。
-
(3) 亚硝酸钠被称为工业盐,有毒,但在肉类制品加工中又可以加入极少量用作发色剂、防微生物剂、防腐剂,在漂白、电镀和金属处理等方面有应用。已知NaNO2能发生反应: NaNO2+HI→NO↑+I2+NaI+H2O
①配平上述化学方程式,并在方程式上面用“双线桥”标明电子转移的方向和数目。
②该反应中HI表现的性质是;氧化剂与还原剂的物质的量之比为;反应中转移0.3 mol电子时生成标准状况下的NOL。
③误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒,维生素C在解毒过程中作剂。
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A . 常温常压下,1 mol 与足量的
与足量的 或
或 反应,转移的电子数目都为2NA
B . 常温下,27 g Al与足量的氢氧化钠溶液反应,转移的电子数目为3NA
C . 标准状况下,22.4 L
反应,转移的电子数目都为2NA
B . 常温下,27 g Al与足量的氢氧化钠溶液反应,转移的电子数目为3NA
C . 标准状况下,22.4 L  中含有的分子数目为NA
D . 物质的量浓度为0.5mol/L的
中含有的分子数目为NA
D . 物质的量浓度为0.5mol/L的 溶液中,含有
溶液中,含有 的个数为NA
的个数为NA
 与足量的
与足量的 或
或 反应,转移的电子数目都为2NA
B . 常温下,27 g Al与足量的氢氧化钠溶液反应,转移的电子数目为3NA
C . 标准状况下,22.4 L
反应,转移的电子数目都为2NA
B . 常温下,27 g Al与足量的氢氧化钠溶液反应,转移的电子数目为3NA
C . 标准状况下,22.4 L  中含有的分子数目为NA
D . 物质的量浓度为0.5mol/L的
中含有的分子数目为NA
D . 物质的量浓度为0.5mol/L的 溶液中,含有
溶液中,含有 的个数为NA
的个数为NA
下列事实及其解释错误的是( )
A . 氯水可以使有色布条褪色,是因为 具有漂白性
B . 钠保存在煤油中是因为煤油不与钠反应且密度比钠小,可以隔绝空气和水蒸气
C . 为增强漂白能力向漂白粉溶液中加入少量白醋,原因是醋酸的酸性比次氯酸强
D . 向包有
具有漂白性
B . 钠保存在煤油中是因为煤油不与钠反应且密度比钠小,可以隔绝空气和水蒸气
C . 为增强漂白能力向漂白粉溶液中加入少量白醋,原因是醋酸的酸性比次氯酸强
D . 向包有 的脱脂棉吹气,脱脂棉燃烧,说明
的脱脂棉吹气,脱脂棉燃烧,说明 、
、 与
与 反应放热且有
反应放热且有 生成
生成
 具有漂白性
B . 钠保存在煤油中是因为煤油不与钠反应且密度比钠小,可以隔绝空气和水蒸气
C . 为增强漂白能力向漂白粉溶液中加入少量白醋,原因是醋酸的酸性比次氯酸强
D . 向包有
具有漂白性
B . 钠保存在煤油中是因为煤油不与钠反应且密度比钠小,可以隔绝空气和水蒸气
C . 为增强漂白能力向漂白粉溶液中加入少量白醋,原因是醋酸的酸性比次氯酸强
D . 向包有 的脱脂棉吹气,脱脂棉燃烧,说明
的脱脂棉吹气,脱脂棉燃烧,说明 、
、 与
与 反应放热且有
反应放热且有 生成
生成
下列说法错误的是( )
A . 过氧化钠可用作潜艇的供氧剂
B . 金属钠保存在煤油中是由于钠不与煤油反应且密度比煤油的大
C . 漂白粉、漂白液均可用于游泳池消毒
D . 纯净的氯气可用于漂白干燥的棉麻织物
最近更新



