两性氧化物和两性氢氧化物 知识点题库
①NaHCO3②(NH4)2CO3③Al2O3④Al(OH)3⑤Al
甲  乙
乙 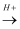 甲.
甲.
 D . CO2
D . CO2
①NaHCO3 ②Al ③Al2O3 ④Al(OH)3 ⑤Na2SO4 .
①Ba(OH)2②Al ③NaHCO3④Al2O3⑤NaHSO4⑥氨基酸 ⑦NH4HS.
-
(1) 与水反应产生无色气体的是(填序号,下同);反应涉及到的方程式是.
-
(2) 遇KSCN溶液显红色的是;
-
(3) 常温下能使铁表面生成致密氧化膜的是;
-
(4) 既能与酸反应又能与碱反应的是,反应中涉及到的离子方程式(2个).
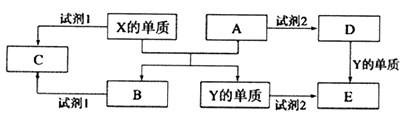
-
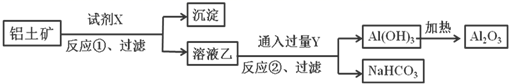
(1) X的单质与A反应的化学方程式是。
-
(2) 若试剂1是NaOH溶液。X的单质与试剂1反应的离子方程式是。
-
(3) 若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是。
②1molC物质与NaOH溶液反应,产生0.5mol沉淀,需消耗NaOH的物质的量为。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4 , 反应中有NO生成,该反应的化学方程式是。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
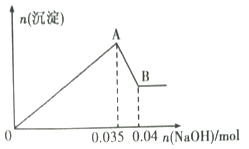
根据上述实验和图中数据:
-
(1) 该废水中一定不含有的离子有(填离子符号);
-
(2) 写出A→B 过程中发生反应的离子方程式:;
-
(3) 该废水中,c(Al3+)=;
-
(4) ①实验室配制100mL2mol/L的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要(填仪器名称)。
②下列操作使所配溶液浓度偏大的是(填写字母)。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体贱出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
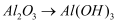 B .
B .  C .
C . 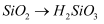 D .
D . 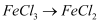
①SiO2 ②Al2O3 ③KAl(SO4)2 ④Ca(HCO3)2 ⑤(NH4)2CO3 ⑥Al
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀生成 | AlO |
| B | 实验室常用MgSO4溶液与NaOH溶液制备Mg(OH)2沉淀 | Mg(OH)2不溶于强碱 |
| C | 铝粉和氧化铁粉末可发生铝热反应 | 铝单质具有还原性 |
| D | 盐酸、氨水均能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
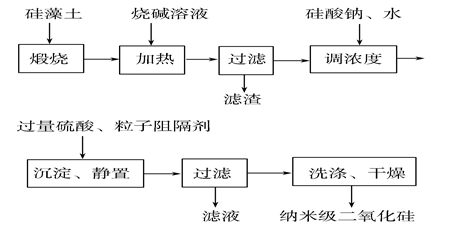
请回答下列问题:
-
(1) 煅烧硅藻土的目的是。
-
(2) 在加热条件下加入烧碱溶液时,发生反应的化学方程式为、。
-
(3) 加入过量硫酸后,生成沉淀的离子方程式为。
-
(4) 若用纳米级二氧化硅制成水溶液,则该溶液所具有的性质与下列图片有关的是(填字母)。


 结合H+能力比CO
结合H+能力比CO  强
强


