两性氧化物和两性氢氧化物 知识点题库
(1)既能与强酸反应,又能与强碱反应的是 (填序号).
(2)属于电解质的是 (填序号).
(3)写出最适宜制取Al(OH)3的离子方程式: .
(4)两物质间发生反应的离子方程式为H++OH﹣=H2O,请写出该反应的化学方程式: .
(5)34.2g⑦溶于水配成500mL溶液,则溶液中SO42﹣的物质的量浓度为 .
-
(1) 常作为潜水艇和呼吸面具中氧气的淡黄色固体是;
-
(2) 常用于焙制糕点,也可用作抗酸药的是;
-
(3) 属于两性氧化物的是;
-
(4) 属于红棕色固体是.
①Al ②Al2O3③Al(OH)3 ④NaHSO3⑤(NH4)2CO3⑥(CH3COO)2Cu⑦NH2﹣CH2﹣COOH.
①Ca(HCO3)2②Al(OH)3③NaAlO2④(NH4)2CO3⑤Al.
①H++OH-=H2O; ②Al(OH)3+OH-=AlO2-+2H2O; ③Al3++3OH-=Al(OH)3↓;
④NH4++OH-=NH3·H2O; ⑤NH4++AlO2-+2H2O=Al(OH)3↓+NH3·H2O。
其正确的离子反应顺序是( )
-
(1) 工业上用钛矿石(主要成分为FeTiO3 , 主要含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:
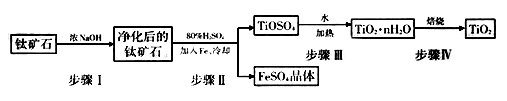
其中,步骤II发生的主要反应为:2H2SO4+ FeTiO3=TiOSO4+FeSO4+2H2O
①步骤I发生反应的离了方程式是:、。为提高钛矿石的碱浸出速率,步骤I可采取的办法除提高碱的浓度外,还可以采取的办法有、(写出两种方法)。
②步骤II中加入Fe的目的是;分离出FeSO4晶体的操作是。
③步骤III形成的TiO2·nH2O 为胶体,其反应的化学方程式为。
-
(2) 可利用TiO2通过下述两种方法制备金属钛:
方法一: 将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是,可能生成的气体是。
方法二: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g)
 TiCl4(g)+O2(g) △H=+ 151kJ/mol
TiCl4(g)+O2(g) △H=+ 151kJ/mol②TiCl4+2Mg
 2MgCl2+Ti
2MgCl2+Ti实际生产中,需在反应①过程中加入碳,可以顺利制得TiCl4。碳的作用除燃烧放热外,还具有的作用是。
![]()
-
(1) 请写出镓(与铝同主族的第四周期元素)的原子结构示意图。
-
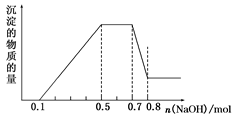
(2) 为尽量少引入杂质,试剂①应选用(填标号)。理由是。
A.HCl溶液
B.H2SO4 溶液
C.氨水
D.NaOH溶液
-
(3) 沉淀B的化学式为;将少量明矾溶于水,溶液呈弱酸性,其原因是(用离子方程式表示)。
-
(4) 科学研究证明NaAlO2 在水溶液中实际上是Na[Al(OH)4](四羟基合铝酸钠),易拉罐溶解过程中主要反应的化学方程式为。
-
(5) 常温下,等pH的NaAlO2 和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=。
-
(6) 已知室温下,Kw=10×10-14 , Al(OH)3
 AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于。
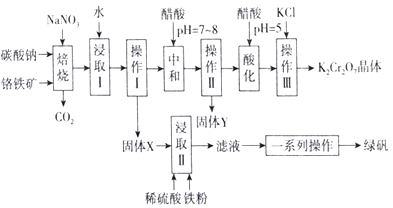
已知:Ⅰ.常见离子沉淀的pH范围
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀 | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全 | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
Ⅱ.焙烧过程中主要发生反应:2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2Cr2O4+Fe2O3+ 4CO2 ↑+7NaNO2。
-
(1) 绿矾的化学式为。
-
(2) 焙烧后的混合物中除含有Na2Cr2O4、NaNO2和过量的Na2CO3、NaNO3外,还含有NaAlO2和Na2SiO3等物质,则焙烧过程中NaAlO2的化学方程式为。
-
(3) 固体Y的主要成分为(填写化学式)。
-
(4) 酸化过程中用醋酸调节pH=5的目的为;若pH调节的过低,NO2-可被氧化为NO3- , 其离子方程式为。
-
(5) 调节pH=5后,加入KCl 控制一定条件,可析出K2Cr2O7晶体,说明溶解度的大小:K2Cr2O7Na2Cr2O7(填“大于”或“小于”)。
-
(6) 流程中的一系列操作为。

部分阳离子完全沉淀时溶液的pH如下:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
9.2 |
回答如下问题:
-
(1) 碱浸的目的是为了除去
-
(2) 某学习小组在实验室中模拟上述流程,简述洗涤滤渣①的操作
-
(3) 加入H2O2并保温一段时间过程中,保温的温度不宜过高的原因为,加入H2O2发生反应的离子方程式为。加入H2O2保温后调pH,下列范围合理的是(填选项序号)。
A.1.8~3.2
B.2.0~3.0
C.3.3~5.2
D.9.2~9.7
-
(4) 滤渣③的主要成分为,滤液③调pH为2~3的目的为
-
(5) 为测定产品中NiSO4·7H2O纯度,某同学将一定量的样品溶于水,再向其中加入足量的BaCl2溶液,过滤、洗涤沉淀并干燥,称量质量。通过计算发现产品中NiSO4·7H2O的质量分数大于100%,其可能的原因为
 B .
B .  C .
C .  D .
D . 
回答下列问题:
-
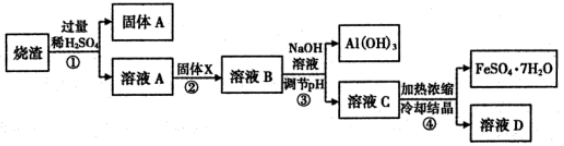
(1) 硫铁矿的主要成分是FeS2 , 其中铁元素化合价为,焙烧产物之一的Fe2O3 , 俗称。
-
(2) 固体A的主要成分是,固体X为。
-
(3) 写出①中Al2O3发生反应的离子方程式:。
-
(4) 从溶液C到绿矾的过程中,须控制反应条件防止变质,检验其变质所用的化学试剂是,步骤③所得Al(OH)3沉淀含有杂质,应如何洗涤?。
①硫酸、苛性钠、纯碱和生石灰分别属于酸、碱、盐和氧化物
②氯仿、硫酸钡和苯酚分别属于非电解质、强电解质和弱电解质
③ 、
、 、
、 属于碱性氧化物
属于碱性氧化物
④根据分散系是否具有丁达尔效应将分散系分为溶液、胶体和浊液
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
⑥ 、
、 、
、 都能与碱溶液发生反应,因此它们都属于酸性氧化物
都能与碱溶液发生反应,因此它们都属于酸性氧化物



