铜及其化合物 知识点题库
(1)在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是 .
(2)写出CuH在氯气中燃烧的化学反应方程式 .
(3)CuH溶解在稀硫酸中生成的气体是 ,如果反应中生成了标况下22.4L的气体,转移电子的物质的量是 .
铜  铜绿
铜绿  A
A  Cu(OH)2
Cu(OH)2  B
B  Cu
Cu
-
(1) 从三种不同分类标准回答,“铜绿”属于哪类物质?.
-
(2) 请写出②处的离子方程式.,
-
(3) 上述转化过程中属于氧化还原反应的是(填序号,下同),属于复分解反应的是
-
(1) CuCl制备过程中需配制物质的量浓度为2.0mol/L的CuSO4溶液.
①配制950mL 2.0mol/L的CuSO4溶液应称取胆矾的质量为g.
②某学生实际配制CuSO4溶液的浓度为1.8mol/L,原因可能是.
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时仰视刻度
-
(2) 写出用上述方法制备CuCl的离子方程式.
-
(3) 在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品.其中“于70℃真空干燥”的目的是;.(回答两点)
-
(4) 据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl.其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2 , HO2(超氧酸) 不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示正确的是 .A . 氧化产物是HO2 B . HO2在碱中能稳定存在 C . HO2 的电离方程式是HO2⇌H++O2﹣ D . 1mol Cu 参加反应有2mol电子发生转移.
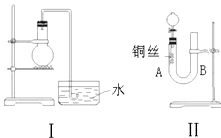
-
(1) 用Ⅰ装置做实验时,实验过程中由于观察到烧瓶内有现象,而不能有力证明反应产物是NO.
-
(2) 用Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到为止.
a.刚好浸没铜丝下端 b.刚好浸没铜丝中部 c.单孔塞下沿与液面间不留有空隙
②关闭活塞,用酒精灯对U形管的A侧加热,当时,撤去酒精灯.
-
(3) 在(2)的实验中:
①什么情况下反应自动停止?.何处观察到无色的NO气体?.
②如果再将分液漏斗的活塞慢慢打开,可在分液漏斗中观察到哪些明显现象?
-
(1) 写出①的离子方程式:;
-
(2) 写出②的离子方程式:;
-
(3) 写出③析出的深蓝色的晶体的化学式.
-
(4) 实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有
-
(5) 实验过程中加入乙醇后可观察到析出深蓝色晶体.实验中所加乙醇的作用是.
[铜矿石]  [铜精矿石]
[铜精矿石]  [冰铜]
[冰铜]  [粗铜]
[粗铜]  [电解铜]
[电解铜]
-
(1) 在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物.
①该过程中两个主要反应的化学方程式分别是、;
②反射炉内生成炉渣的主要成分是.
-
(2) 冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化为Cu2O.生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜.该过程发生反应的化学方程式分别是、.
-
(3) 粗铜的电解精炼如图所示.
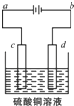
①在粗铜的电解过程中,粗铜板应是图中电极(填图中的字母);
②在电极d上发生的电极反应式为;
③若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为.
选项 | 描述 | 分析 |
A | “熬胆矾铁釜,久之亦化为铜” | 其反应原理是电镀 |
B | “以火烧之,紫青烟起,乃真硝石(KNO3)” | “紫青烟”是因为发生了焰色反应 |
C | “司南之杓(勺),投之于地,其柢(勺柄)指南” | 司南中“杓”的材质为Fe3O4 |
D | “用浓酒和糟入甑,蒸令气上,用器承滴露” | 其中涉及的操作是蒸馏 |
 Cl2(g)
Cl2(g) 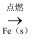 FeCl2(s)
B . Cu(OH)2(s)
FeCl2(s)
B . Cu(OH)2(s)  CuO(s)
CuO(s)  CuSO4(aq)
C . N2(g)
CuSO4(aq)
C . N2(g)  NH3(g)
NH3(g) 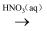 NH4NO3(s)
D . Al2O3(s)
NH4NO3(s)
D . Al2O3(s) 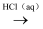 AlCl3(aq)
AlCl3(aq)  AlCl3(s)
AlCl3(s)

已知:SOCl2 熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。请回答:
-
(1) 写出第②步调 pH适合的一种物质(填化学式),调 pH 后需进行的操作是。
-
(2) 第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是将溶液转移至蒸发皿中,缓缓加热至。
-
(3) 第④步中发生反应的化学方程式是。
-
(4) 第④步,某同学设计的实验装置示意图(如图,夹持及控温装置省略)有一处不合理,请提出改进方案并说明理由。

装置改进后,向仪器 A 中缓慢滴加 SOCl2 时,需打开活塞(填“a”“b”或“a 和 b”)。
-
(5) Cu(NO3)2·3H2O在170℃可失去结晶水变成Cu(NO3)2 , 若加热时间过长,Cu(NO3)2则会分解为一种黑色的固体,一种红棕色气体和另一种单质气体,写出反应的化学方程式:。
-
(6) 为测定无水Cu(NO3)2 产品的纯度,可用分光光度法。
已知:4NH3·H2O+Cu2+=Cu(NH3)42++4H2O;Cu(NH3)42+对特定波长光的吸收程度(用吸光度A表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与 Cu2+标准溶液浓度关系如图所示:

准确称取0.3150g无水Cu(NO3)2 , 用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是(以质量分数表示)。
-
(1) 某同学进行CO2与Na2O2反应的探究实验,将100 mL纯净的CO2通过一定量的Na2O2粉末,反应后气体体积为65 mL,则反应消耗CO2的体积是mL。
-
(2) 已知铜和浓硫酸可以在加热条件下发生反应:Cu + H2SO4(浓) →CuSO4 + SO2↑ +H2O(方程式未配平),如果一定量的铜片与100mL 18mol/L的浓H2SO4充分反应,在反应过程中转移了0.2mol电子,将反应后所得到的溶液(不考虑SO2的溶解)经一定稀释后与足量Ba(OH)2溶液充分反应。计算反应后所得沉淀的质量为g(保留到0.1g)。
-
(3) 现有 NaOH 和 Ba(OH)2 混合溶液 100mL,已知该溶液中 c(OH-)=1mol/L,向溶液中缓缓通入CO2气体(溶液体积变化忽略不计)),当至少通入CO2气体体积为 0.56L(标准状况)时生成的沉淀最多,那么当通入CO2气体体积为1.792 L(标况)时,溶液中HCO
 的物质的量浓度是mol/L。
的物质的量浓度是mol/L。
-
(1) NO的体积;
-
(2) 待产生的气体全部逸出后,向溶液中加入 V mL a mol.L-1 的 NaOH 溶液,恰好使溶液中的 Cu2+全部转化成沉淀,则原 HNO3 溶液的浓度为。
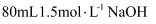 溶液恰好中和。
溶液恰好中和。  请回答:
请回答:
-
(1) 组成X的三种元素是(真元素符号),X的化学式是。
-
(2) 步骤I发生反应的离子方程式是。
-
(3) Mg在气体E中剧烈燃烧生成两种固体化合物,该反应的化学方程式是。
-
(4) 步骤II,为使铜片进一步溶解,可向反应后的混合物中加入(填序号)。
①稀
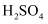 ②
② 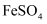 ③
③  ④
④ 
-
(5) 将体积比为
 的气体E和
的气体E和  的混合气体通入水中制得Y的浓溶液。该浓溶液与Cu反应得到绿色溶液,有同学认为溶液呈绿色是因为溶有气体E,设计实验方案证明。
的混合气体通入水中制得Y的浓溶液。该浓溶液与Cu反应得到绿色溶液,有同学认为溶液呈绿色是因为溶有气体E,设计实验方案证明。




