铜及其化合物 知识点题库
铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。在化学反应中,铜元素可表现为0、+1、+2价。
-
(1) 在西汉古籍中曾有记载:“曾青得铁则化为铜”[即曾青(CuSO4)跟铁生成铜],试写出该反应的离子方程式: 。
-
(2) 尽管铜比铁较为稳定,但铜器表面经常会生成铜锈[即铜绿,化学式为Cu2(OH)2CO3],其中生成铜绿的反应物除铜外还有O2、CO2和H2O。试写出保护铜制品的方法:;这层铜绿可用化学方法除去,试写出除去铜绿而不伤器物的反应方程式: 。
-
(3) 铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币(铜的熔点是1 083.4 ℃,铁的熔点是1 534.8 ℃)。
下列说法不正确的是( )
A . 生物炼铜比高温炼铜更清洁、成本更低
B . 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用
C . 用福尔马林灭活埃博拉病毒是利用了蛋白质变性原理
D . 扫描隧道显微技术、超分辨率荧光显微技术等技术的发展促进了人类对物质微观结构的探索,使科学研究迈入更高水平层次
下列有关金属的说法中,正确的是( )
A . 钠在空气中燃烧只生成白色的氧化钠固体
B . 燃着的镁条伸入盛满二氧化碳的集气瓶中不能继续燃烧
C . 铜能与氯化铁溶液反应,该反应可以用于印刷电路板的制作
D . 铁能与硫酸发生反应,故不能用铁制容器贮存浓硫酸
为验证铜与稀硝酸反应的还原产物是NO而不是NO2 . 某同学设计了如图所示的装置,下列叙述错误的是( )

A . 应先打开活塞和旋塞再从U型管右侧加入稀硝酸
B . 加入的稀硝酸应充满U型管左侧
C . 关闭旋塞后铜丝会全部溶解
D . 反应停止后打开活塞,气体变成红棕色
下列说法不合理的是( )
A . 在稀硫酸中加入铜粉,铜粉不溶解,若加入KNO3固体,铜粉溶解
B . “溶洞”的形成过程中发生了碳酸钙与水、CO2的反应
C . 采用催化转化技术可以将汽车尾气中的氮氧化物CO转化为无毒气体
D . FeCl3、Na2O2、CuS均可由相应的单质直接化合而成
下列不能通过单质间反应而制得的物质是( )
A . CuCl2
B . CuO
C . FeCl2
D . HCl
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示,下列说法不正确的是( )

A . 相对于途径①,途径②更好地体现了绿色化学思想
B . Y可以是蔗糖溶液
C . 利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol
D . 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
下列物质性质与应用对应关系正确的是( )
A . 硫酸铜溶于水呈酸性,可用来做杀菌剂
B . 氨气具有还原性,可用于检查HCl泄漏
C . MgO、Al2O3熔点高,可用于制作耐高温坩埚
D . FeCl3溶液显酸性,可用于蚀刻印刷电路板
将铜丝灼烧变黑后立即插入下列物质中,铜丝变红,且质量不变的是( )
A . H2SO4
B . C2H5OH
C . Ca(OH)2
D . HNO3
如图是铜与稀硝酸反应的实验装置,请回答下列问题:

-
(1) 铜与稀硝酸反应的离子方程式.
-
(2) 实验装置中能否证明铜与稀硝酸反应生成的是NO气体(填“能”或“不能”),简述理由.
探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质:
-
(1) 分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸 ④稀硝酸,能随即发生反应的是③,微热则发生反应的是④,加热后发生反应的是①,加热也不发生反应的是②.由此可以得到上述四种酸氧化性由强到弱的顺序是.
-
(2) 先将铜与浓硫酸反应产生的气体X持续通入如右图所示装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括 (选填序号).
 A . 通入X气体后产生白色沉淀 B . 通入X气体后溶液中无明显现象 C . 通入Y气体开始产生沉淀 D . 通入Y气体后沉淀溶解 E . 通入Y气体后溶液中无明显现象
A . 通入X气体后产生白色沉淀 B . 通入X气体后溶液中无明显现象 C . 通入Y气体开始产生沉淀 D . 通入Y气体后沉淀溶解 E . 通入Y气体后溶液中无明显现象 -
(3) 由此可得到的结论是 (选填序号).A . HNO3的酸性比H2SO4强 B . 盐酸的酸性比H2SO3强 C . BaSO3能溶于盐酸 D . HNO3能氧化H2SO3(或SO2) E . BaSO4不溶于水也不溶于HNO3溶液.
下列离子方程式,正确的是( )
A . 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B . 将铜片插入硝酸银溶液中:Ag++Cu = Cu2++Ag
C . 氢氧化镁与稀盐酸混合OH-+H+=H2O
D . 向浓NaOH溶液中滴入几滴氯化铵溶液并加热:NH4++OH-  NH3↑+H2O
NH3↑+H2O
 NH3↑+H2O
NH3↑+H2O
(孔雀石主要成分Cu2(OH)2CO3 (含少量FeO、SiO2)。某兴趣小组用孔雀石制备CuSO4·5H2O,所设计的工艺流程如下所示:

回答下列问题:
-
(1) 从CuSO4溶液中获取CuSO4·5H2O所进行的操作是加热、蒸发浓缩、、过滤。
-
(2) 溶解池中所发生的化学反应方程式为,。
-
(3) 选择的试剂①为。
A.KMnO4
B.NaClO
C.Cl2
D.H2O2
反应池Ⅰ中发生反应的离子方程式为。
-
(4) 含Cu2(OH)2CO3质量分数为c%的孔雀石dg,理论上能获取CuSO4·5H2O的质量为。
下列化合物中,不能通过单质间化合直接制取的是( )
A . FeCl2
B . CuCl2
C . Na2O2
D . Na2O
下列叙述正确的是( )
A . Fe与S混合加热生成FeS2
B . NaHCO3的热稳定性大于Na2CO3
C . 过量的铜与浓硝酸反应有一氧化氮生成
D . 白磷在空气中加热到一定温度能转化为红磷
氯化亚铜(CuCl)是一种重要的化工产品。它难溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在水溶液中存在平衡:CuCl(白色)+2Cl﹣⇌[CuCl3]2﹣(无色溶液)。在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4﹣nCln],n随着环境酸度的改变而改变。某研究小组设计如下两种方案制备氯化亚铜。
-
(1) 方案一:铜粉还原CuSO4溶液
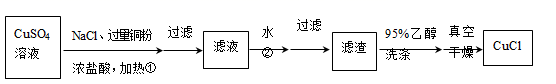
请回答:
步骤①中发生反应的离子方程式为。
-
(2) 步骤②中,加入大量水的作用是。
-
(3) 如图流程中用95%乙醇洗涤和真空干燥是为了防止。
-
(4) 随着pH减小,Cu2(OH)4﹣nCln中铜的质量分数。
A.增大 B.不变 C.减小 D.不能确定
-
(5) 方案二:在氯化氢气流中加热CuCl2•2H2O晶体制备,其流程和实验装置(夹持仪器略)如图:

请回答:
实验操作的先后顺序是a→→→→e(填操作的编号)
a检查装置的气密性后加入药品b点燃酒精灯,加热
c在“气体入口”处通入干燥HCl d熄灭酒精灯,冷却
e停止通入HCl,然后通入N2
-
(6) 在实验过程中,观察到B中无水硫酸铜由白色变为蓝色,C中试纸的颜色变化是。
-
(7) 反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2杂质,请分析产生CuCl2杂质的原因。
工业上用洗净的废铜屑作原料来制备硝酸铜,为节约原料和防止环境污染,宜采用的方法是( )
A .  稀
稀  B .
B .  浓
浓  C . Cu
C . Cu  CuSO4
CuSO4  Cu(NO3)2
D . Cu
Cu(NO3)2
D . Cu  CuO
CuO  Cu(NO3)2
Cu(NO3)2
 稀
稀  B .
B .  浓
浓  C . Cu
C . Cu  CuSO4
CuSO4  Cu(NO3)2
D . Cu
Cu(NO3)2
D . Cu  CuO
CuO  Cu(NO3)2
Cu(NO3)2
某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。甲同学取agCu片和12mL18mol/L浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的硫酸和Cu剩余。

-
(1) A装置盛放有Cu的仪器名称:,C装置收集气体的方法为:。
-
(2) D中试管口放置的棉花中应浸一种液体,这种液体是,其作用是。
-
(3) 装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,装置A仍有气体产生,此时装置B中试剂瓶中液面下降,长颈漏斗中液面上升。装置B中应放置的液体是(填字母)。
a.饱和Na2SO3溶液 b.酸性KMnO4溶液 c.饱和NaHSO3溶液 d.浓溴水
-
(4) 反应完毕后,烧瓶中还有一定量的余酸,却不能使Cu完全溶解的原因是。加入足量的下列药品不能证明反应结束后烧瓶中还有硫酸剩余的是(填字母)。
a.NaCl溶液 b.Fe粉 C.CuO d. Na2SO3溶液
-
(5) SO2是形成酸雨的主要物质,对环境污染很大,为了减少工业上煤、石油等燃烧产生SO2的排放,可用氨水将SO2转化为NH4HSO3 , 再氧化成(NH4)2SO4来脱除烟气中的SO2 , 请写出NH4HSO3溶液在空气中氧化成(NH4)2SO4的离子反应方程式:。
化学实验中常伴有各种现象的产生,下列实验现象叙述错误的是( )
A . Na在Cl2中燃烧,发出黄色火焰
B . 向氯水中滴加AgNO3溶液,产生白色沉淀
C . 将Cu加入浓硫酸中,立即有大量气泡产生
D . 将铜丝在酒精灯上灼烧至红热,铜丝表面变黑,立即插入乙醇中,铜丝又变为红色
某同学通过实验研究铜盐溶液颜色的变化。下列说法错误的是( )

A . 由①②可知,②中溶液呈蓝色是Cu2+与水分子作用的结果
B . 由④可知,Cu2+与Cl−可能会结合产生黄色物质
C . 由③④可知,Cl−的浓度对铜盐溶液的颜色有影响
D . 由②③④可知,CuCl2溶液一定为绿色
最近更新



