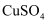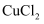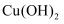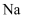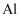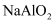铜及其化合物 知识点题库
①富集:将硫化物矿石进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2→Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃主要的反应为:2Cu2S+3O2→2Cu2O+2SO2;2Cu2O+Cu2S→6Cu+SO2↑;
④电解精炼,在阴极得到精铜。
下列说法不正确的是( )
2Cu+=Cu2++Cu.
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是 (填氧化剂或还原剂).
(2)写出CuH在氯气中燃烧的化学反应方程式
(3)CuH溶解在稀盐酸中生成的气体是 (填化学式)
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式 .
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| 加入 试剂 | 稀硫酸 | 浓硫酸、 加热 | 稀硝酸 | 浓硝酸 |
| 实验 现象 | 红色固体和蓝色溶液 | 无色气体和蓝色溶液 | 无色气体和蓝色溶液 | 红棕色气体和蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物是( )
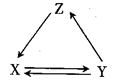
| X | Y | Z | 物质转化关系 | |
| A | Cu | CuO | Cu(OH)2 | |
| B | Si | SiO2 | H2SiO3 | |
| C | NaHCO3 | Na2CO3 | NaOH | |
| D | FeCl2 | FeO | FeCl3 |
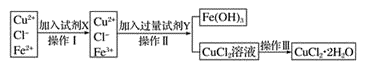
请参照下表给出的数据填空。

-
(1) 操作I加入X的目的是 。
-
(2) 下列物质都可以作为X,适合本实验的X物质可以是(填字母)。
A KMnO4 B NaClO C H2O2 D Cl2
-
(3) 操作II的Y试剂为(填化学式),并调节溶液的pH在范围。
-
(4) 实验室在配制CuCl2溶液时需加入少许(填物质名称),理由是(文字叙述并用有关离子方程式表示)。
-
(5) 若将CuCl2溶液蒸干灼烧,得到的固体是(填化学式);若要得无水CuCl2 , 请简述操作方法。

下列说法错误的是( )
![]()
-
(1) 写出加入过量①时FeCl3溶液发生反应的离子方程式:。
-
(2) 检验废腐蚀液中是否含有Fe3+所需试剂名称:,反应的离子方程式为:。
-
(3) 向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:,此转化的化学方程式为:。
-
(4) 通入⑥发生反应的离子方程式:。通入⑥的反应还可以改用加入过氧化氢和稀盐酸的方法,则发生反应的离子方程式:。
| 选项 | W | X | Y | Z | |
| A | | | | | |
| B | | | | | |
| C | | | | | |
| D | S | | | |
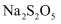 (焦亚硫酸钠)制备原理,实验操作如下:
(焦亚硫酸钠)制备原理,实验操作如下: | 实验步骤 | 实验操作 |
| 第一步 | 连接实验装置并检查装置气密性 |
| 第二步 | A、C、D中装入药品,加热A中试管,通过pH数据采集器控制C中反应至 |
| 第三步 | 将C中所得溶液转移至蒸发装置中,加热,结晶脱水、过滤、洗涤、干燥制得焦亚硫酸钠( |
已知: 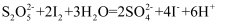 ;
;  ,实验装置如下:
,实验装置如下:

回答下列问题:
-
(1) 写出A中反应的化学方程式为。装置B的作用是。
-
(2) 第二步控制C中
 ,若C中溶质只有一种,C中反应的离子方程式是。
,若C中溶质只有一种,C中反应的离子方程式是。
-
(3) 第三步加热过程中若温度过高可能会生成
 和M两种正盐,M的化学式是,鉴别M中阴离子的方法是,过滤操作用到的玻璃仪器有。
和M两种正盐,M的化学式是,鉴别M中阴离子的方法是,过滤操作用到的玻璃仪器有。
-
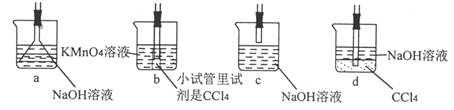
(4) 用于D处合理的装置是(填标号)。
-
(5) 该小组通过下述方法检测某饮料中残留的
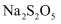 :
: ①取100.00
 饮料于锥形瓶中,加入
饮料于锥形瓶中,加入  的
的  溶液,塞紧瓶塞充分反应。
溶液,塞紧瓶塞充分反应。②打开瓶塞,将锥形瓶内液体调至接近中性,滴加4~5滴淀粉溶液变蓝。用
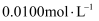 的
的  溶液滴定,滴定至终点时,消耗
溶液滴定,滴定至终点时,消耗  ;溶液39.80
;溶液39.80  ,饮料中残留的
,饮料中残留的 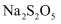 为
为 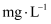 (计算结果保留两位小数)。
(计算结果保留两位小数)。
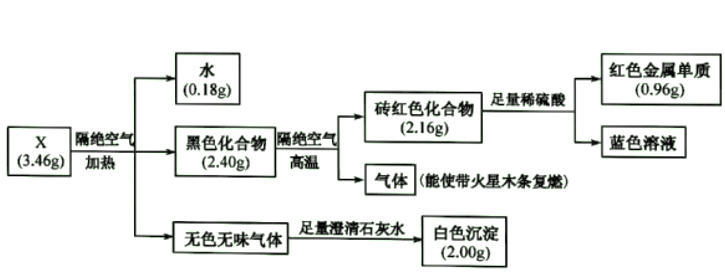
请回答:
-
(1) 蓝色溶液中的金属阳离子是(填写化学式),该金属元素的基态原子价层电子排布式是。
-
(2) 黑色化合物→砖红色化合物的化学方程式是。
-
(3) X的化学式是。