无机物的推断 知识点题库
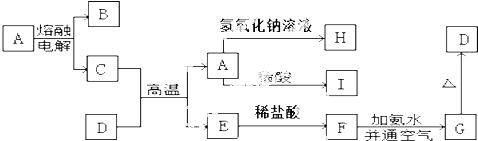
回答下列问题:
-
(1) 填写下列物质的化学式:A;B;D;H.
-
(2) 写出下列反应的方程式:
①C+D→A+E的化学方程式:.
②A→H的离子方程式:.
③F→G的化学方程式:、.
-
(3) F→G反应现象:.

请回答下列问题:
-
(1) A溶液与B溶液反应的离子方程式.
-
(2) 若A与其周围某物质在一定条件下反应,产物之一是B周围的一种,则此反应的离子方程式为
-
(3) 请写出B溶液分别与Cl2、Al(OH)3反应的离子方程式:
-
(4) 在A、B周围的8种物质中,有些既能与A反应又能与B反应.则这些物质可能是:.
 、SO
、SO  ,为了确定溶液的组成,某学生进行如下探究实验:
,为了确定溶液的组成,某学生进行如下探究实验: ①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CCl4振荡,静置,CCl4呈橙色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3 , 有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3 , 有白色沉淀产生.
根据上述实验判断,下列结论正确的是( )
 B . 溶液一定含有Na+ , 不含Ba2+
C . 实验①与上述离子的检验没有关系,可以省略
D . 由实验④可以判断溶液中含有Cl﹣
B . 溶液一定含有Na+ , 不含Ba2+
C . 实验①与上述离子的检验没有关系,可以省略
D . 由实验④可以判断溶液中含有Cl﹣
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42﹣ HCO 3﹣ NO 3﹣ OH﹣ |
为了鉴别上述化合物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
-
(1) 写出C、D的化学式:C,D.
-
(2) 将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,请写出A与E反应的离子方程式:.
-
(3) 在A溶液中加入少量澄清石灰水,其离子方程式为.
-
(4) C常用作净水剂,用离子方程式和适当文字说明其净水原理.
-
(5) 若向含溶质0.5mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为g.

已知: 废钒催化剂中钒元素主要以VOSO4和V2O5形式存在;
V2O5是两性氧化物,不溶于水,溶于酸生成VO2+,溶于碱生成VO3-;
VOSO4是强电解质,溶于水电离出VO2+。
回答下列问题:
-
(1) VOSO4中V 元素的化合价为。
-
(2) 滤渣①酸溶后加入的最佳试剂X 为。
a.NaClO b.Na2SO3c.K2SO3d.K2S
-
(3) 从滤液③中得到产品K2SO4的操作为。滤渣③除含有V2O2(OH)4,还含有。
-
(4) 若滤液⑤中c(VO3-)=0.1mol·L-1,为使钒元素的沉淀率达到98%,至少应调节c(NH4+)为[Ksp(NH4VO3)=1.6×10-3]。
-
(5) “焙烧”时通入足量的空气,反应后的尾气可以直接排放。该反应的化学方程式为。
-
(6) V2O5纯度测定原理: 称取V2O5产品ag,先加入硫酸将V2O5转化为VO2+,再加入V1 mLc1mol·L-1(NH4) 2Fe(SO4) 2溶液将VO2+转 化为VO2+,最 后 用c2mol·L-1KMnO4 溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液V2mL。假设杂质不参与反应,实验测得某V2O5产品的纯度为91%,则理论上加入(NH4)2Fe(SO4)2溶液的体积V1至少mL (用相关字母表示)。
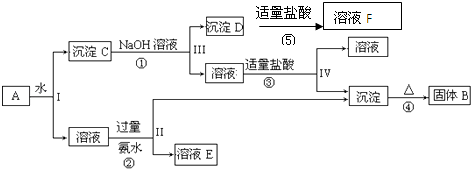
回答下列问题:
-
(1) 写出所含物质的化学式:固体B,沉淀D。
-
(2) 写出①、④两个反应的化学方程式:
①
④
-
(3) 写出②、③两个反应的离子方程式:
②
③
-
(4) 设计实验检验溶液F中所含溶质的阳离子:。
-
(5) 分别写出Al2O3和Fe2O3在工业上的一种主要用途:
Al2O3︰
Fe2O3︰

回答下列问题:
-
(1) A的化学式是,C分子的电子式是。
-
(2) 反应①的离子方程式是;若n(E)∶n(D)=2∶5,反应②的化学方程式是。
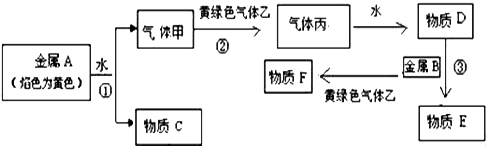
请回答下列问题:
-
(1) 物质F的化学式为.
-
(2) ①写出金属A与水反应的化学方程式:.
②写出黄绿色气体乙和水反应的离子化学方式:.
③实验室制备黄绿色气体的化学方程式:.
-
(3) 金属单质A投入到下列溶液中既有气体,又有沉淀出现的是______A . 氯化钠溶液 B . 碳酸钠溶液 C . 硫酸铜溶液 D . 氯化铵溶液.

查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
-
(1) 固体A的成分是。
-
(2) 操作I、III、IV用到的主要玻璃仪器有玻璃棒和 、(填仪器名称)。
-
(3) ③为加入物质来调节溶液的pH,则pH的合适范围是 。
-
(4) 写出④反应的离子方程式。
-
(5) ⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式。
-
(6) 取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为,固体D中含Fe化合物的物质的量为。

 HClO(aq)
HClO(aq)  HCl(aq)
B . H2SiO3
HCl(aq)
B . H2SiO3  SiO2
SiO2  SiCl4
C . Al
SiCl4
C . Al  Al(OH)3
Al(OH)3  Al2O3
D . Fe2O3
Al2O3
D . Fe2O3  Fe(OH)3
Fe(OH)3  Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
 B .
B .  C .
C .  D .
D . 
 Ca(ClO)2
Ca(ClO)2  HClO
B . SiO2
HClO
B . SiO2  Na2SiO3
Na2SiO3  H2SiO3
C . FeS2
H2SiO3
C . FeS2  (NH4)2SO4
D . 饱和NaCl溶液
(NH4)2SO4
D . 饱和NaCl溶液  NaHCO3
NaHCO3  Na2CO3
Na2CO3
![]()
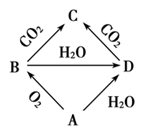
-
(1) 写出B与CO2反应生成C的化学方程式,并用“双线桥”法标出电子转移方向和数目。
-
(2) 写出B与H2O反应生成D的化学方程式,并用“单线桥”法标出电子转移方向和数目。
-
(3) B的用途有。(写两种)
-
(4) C是粉末,向C粉末中加入少量水后,C结块变成晶体,并伴随着现象(填吸热或放热),C的溶液显性(填酸、中或碱)。
-
(5) 向C的饱和溶液中通入CO2气体有白色沉淀生成,写出该反应的化学方程式。

已知:X、Y是生活中常见的金属单质,A、B都是氧化物且A是红棕色粉末。回答下列问题:
-
(1) 单质X与A反应的化学方程式是;
-
(2) 若试剂1和试剂2均是强电解质。
①若试剂1和试剂2的酸碱性相同,则C溶液显(填"酸性"、"碱性"或"中性");
②若试剂1和试剂2的酸碱性不同,试剂1和B的离子反应方程式是;
-
(3) 若试剂2是稀硝酸。
①Y单质与稀硝酸反应生成E时,Y单质必须过量,写出该反应的离子方程式。
②D的阳离子检验可以用试剂检验。
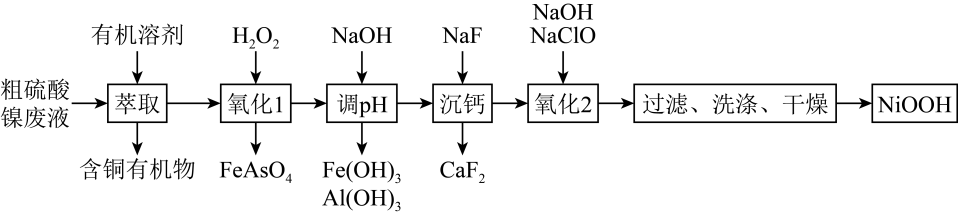
已知:Ksp(FeAsO4)=5.7×10-21 , H3AsO3的还原性比Fe2+强。
回答下列问题:
-
(1) “萃取”时需充分振荡,目的是。
-
(2) “氧化1”中H2O2的作用是,若该废液中H3AsO3和Fe2+的浓度分别是0.02 mol·L-1和0.12 mol·L-1 , 除去砷后的废液中c(
 )=mol·L-1(不考虑反应过程中溶液体积的微小变化)
)=mol·L-1(不考虑反应过程中溶液体积的微小变化)
-
(3) “沉钙”时,若溶液酸度过高,Ca2+沉淀不完全,原因是。
-
(4) “氧化2”反应的离子方程式为。
-
(5) “洗涤”时,检验产品是否洗涤干净的方法是。
-
(6) 已知某镍氢电池的离子导体为KOH溶液,电池反应为MH+NiOOH
 M+Ni(OH)2 , 则放电时,OH-移向电极(填“MH”或“NiOOH”),充电时NiOOH电极上的电极反应式为。
M+Ni(OH)2 , 则放电时,OH-移向电极(填“MH”或“NiOOH”),充电时NiOOH电极上的电极反应式为。



