无机物的推断 知识点题库
由Ca3(PO4)2、SiO2 、焦炭等为原料生产硅胶(SiO2·nH2O)、磷、磷酸及CH3OH,下列工艺过程原料综合利用率高,废弃物少。
-
(1) 上述反应中,属于置换反应的是[选填:(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)、(Ⅴ)]。
-
(2) 高温下进行的反应Ⅱ的化学方程式为;固体废弃物CaSiO3可用于。(答一条即可)
-
(3) 反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是。
-
(4) CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为。
-
(5) 指出(VI)这一环节在工业生产上的意义。
-
(6) 写出由P→H3PO4的有关反应式:
①。
②。
有一包粉末可能含有K+、Fe3+、Al3+、Cl﹣、SO  、CO
、CO  中的若干种,现进行以下实验:
中的若干种,现进行以下实验:
 、CO
、CO  中的若干种,现进行以下实验:
中的若干种,现进行以下实验: ①取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
②向①溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后,向滤液中滴入用硝酸酸化的AgNO3溶液,有白色沉淀生成;
③取②中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
④重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
⑤向④的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤.往得到的沉淀中加入过量的NaOH溶液,沉淀部分溶解.
-
(1) 根据上述实验,这包粉末中一定含有的离子是,不能确定是否含有的离子可通过实验(填实验名称)来进一步确定该离子.
-
(2) ⑤中生成沉淀反应的有关离子方程式是.
-
(3) ⑤中沉淀减少反应的有关化学方程式是.
A,B,C,D为四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3﹣、SO42﹣、Cl﹣、CO32﹣的中的一种.
①若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色.
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出.
根据①②实验事实可推断它们的化学式为:
-
(1) A,C;
-
(2) 写出盐酸与D反应的离子反应方程式:;
-
(3) 写出C与Ba(OH)2溶液反应的离子方程式.
字母A﹣F代表六种不同物质,它们之间可发生如图的转化(部分反应中生成物没有全部列出).其中D是一种强酸;E是一种常见金属,有“国防金属”的美誉,可在CO2中燃烧.分析图示回答下列问题:
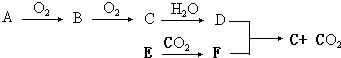
-
(1) A可以是或;
-
(2) E在CO2中燃烧的化学方程式为;
-
(3) D与F反应的化学方程式为,该反应中D表现了性;
-
(4) 50mL 14mol•L﹣1物质D的溶液中加入足量的铜,充分反应后共收集到气体2.24L(标准状况下),则被还原的D的物质的量为mol,参加反应的铜的质量为g.
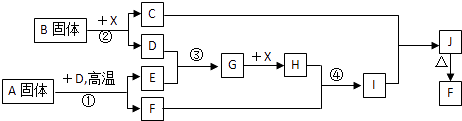
根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%.
-
(1) A的化学式为; F的化学式为;
-
(2) 反应③的化学方程式:;
-
(3) 反应②的离子方程式:;
-
(4) 反应④的离子方程式:;
-
(5) 已知每生成16g E,放出106.5kJ热量,则反应①的热化学方程式为:.
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )
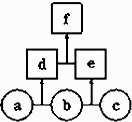
A . 常温下,单质a呈气态
B . 单质c具有强氧化性
C . 稳定性:d>e
D . f受热易分解为d和e
某溶液仅含如表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol.
阳离子 | Na+ Mg2+ Fe3+ Al3+ Fe2+ |
阴离子 | OH﹣ CO32﹣ Cl﹣ NO3﹣ SO42﹣ |
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入少量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变.
请推断:
-
(1) 原溶液中含有的阳离子是; 含有的阴离子是.
-
(2) 向原溶液中加入足量稀盐酸发生反应的离子方程式为.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,A是地壳中含量最多的金属元素.请回答:

-
(1) 写出下列物质的化学式:乙、丁、戊.
-
(2) 写出甲物质在工业上的一种主要用途:.
-
(3) 写出甲→乙+丙反应的离子方程式:;A→乙+C反应的化学方程式:.
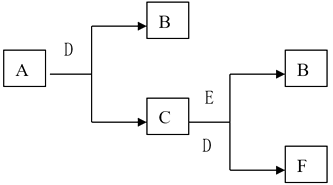
有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和反应的条件没有全部标出)。已知A、B、E是单质,B在常温下为气体,C俗名称为烧碱,D为无色无味液体
-
(1) 写出A、B、F的化学式 A B F 。
-
(2) 写出A和D反应生成B和C的化学方程式。
-
(3) 写出E与C、D反应生成的B和F离子方程式。
为探究工业尾气处理副产品X(黑色固体,仅含两种元素)的组成和性质,设计并完成如下实验:
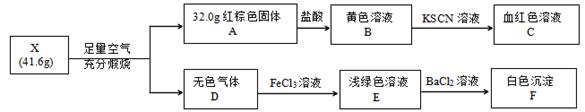
请回答:
-
(1) X含有的两种元素是,其化学式是。
-
(2) 无色气体D与氯化铁溶液反应的离子方程式是。
-
(3) 已知化合物X能与稀盐酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),写出该反应的化学方程式。
A、B均为钾盐的水溶液,A呈中性,B有氧化性,E的溶质中有一种含+5价元素的含氧酸盐M。现有下图所示转化:
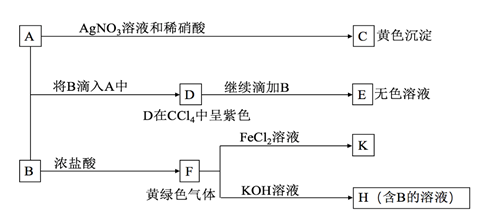
请回答:
-
(1) C的化学式为,检验气体F常用的试纸是
-
(2) 写出物质M在生活中的常见用途
-
(3) 写出F→H的化学方程式:
下列物质的转化在给定条件下能实现的是( )
A . MgO  MgCl2(aq)
MgCl2(aq)  无水MgCl2
B . Al2O3
无水MgCl2
B . Al2O3  NaAlO2(aq)
NaAlO2(aq)  AlCl3
C . Fe
AlCl3
C . Fe  FeCl2
FeCl2  FeCl3
D . Na2O2
FeCl3
D . Na2O2  NaCl(aq)
NaCl(aq)  Na
Na
 MgCl2(aq)
MgCl2(aq)  无水MgCl2
B . Al2O3
无水MgCl2
B . Al2O3  NaAlO2(aq)
NaAlO2(aq)  AlCl3
C . Fe
AlCl3
C . Fe  FeCl2
FeCl2  FeCl3
D . Na2O2
FeCl3
D . Na2O2  NaCl(aq)
NaCl(aq)  Na
Na
短周期主族元素W、X、Y、Z的原子序数依次增大,W的最低负价等于X、Z的最低负价之和,Y的周期数是族序数的3倍,W的简单氢化物与X的简单氢化物化合形成的盐中既含离子键又含共价键。下列说法正确的是( )
A . Y与X形成化合物的水溶液呈碱性.
B . 常压下,单质的沸点:W>Z
C . 原子半径:W<X<Y<Z
D . W的氧化物的水化物的酸性比Z的弱
下列物质A-F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;适当的条件下,它们之间可以发生如图所示的转化。
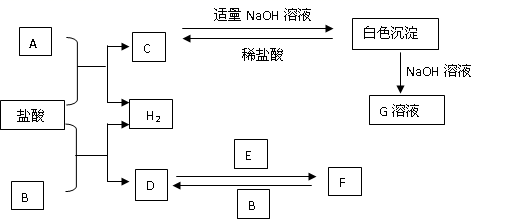
-
(1) A的原子结构示意图;G溶液中溶质的化学式为。
-
(2) 请写出反应D→F的化学方程式:。
-
(3) 检验F中金属阳离子的常用试剂是(填物质的化学式);现象是。
-
(4) E物质可与石灰乳反应制取漂白粉,写出漂白粉的有效成分。
-
(5) 写出C与足量氢氧化钠溶液反应的离子方程式。
-
(6) FeCl3溶液和氢氧化铁胶体的本质区别是。
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知A、I为常见金属单质,B、H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
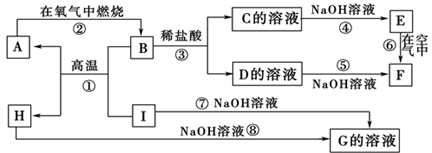
请填写下列空白:
-
(1) A、B、C、D、E、F六种物质中所含的同一种元素的名称是,H的化学式为。
-
(2) 反应③的离子方程式为 ,向G中通少量CO2的离子方程式为。
-
(3) 反应⑥化学方程式。
-
(4) C中阳离子检验方法:。
-
(5) 1mol I发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准况下占L。
已知某物质X能发生如下转化:

下列有关上述转化关系中物质及其反应的叙述错误的是( )
A . 若X为N2 , 则A为硝酸
B . 若X为S,则A为硫酸
C . 反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
D . 若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
某化合物 A 由两种元素组成,可以发生如下的转化。
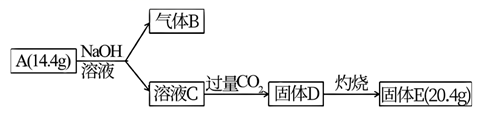
已知∶标准状况下,气体B的密度是氢气的8倍;固体E既溶于NaOH溶液又可溶于稀硫酸。
请回答∶
-
(1) B的化学式是
-
(2) 组成A的元素有
-
(3) 请写出 A 与 NaOH溶液反应的化学方程式
已知:A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,H是白色沉淀,W溶液中加入KSCN溶液出现血红色。各物质之间的转化关系如下图所示,请回答下列问题:

-
(1) 写出化学式:A,D,R;
-
(2) W溶液中加入KSCN溶液出现血红色,说明W溶液中含有离子(用离子符号表示)。
-
(3) H→M的过程中,可能观察到的现象为。
-
(4) 写出A→B+C的化学方程式;在C与R反应中,当有20.4gQ物质生成时,转移电子mol。
-
(5) D→E过程中②的离子方程式。
硫酸铁铵晶体[NH4Fe(SO4)2·12H2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如图:

回答下列问题:
-
(1) NH4Fe(SO4)2·12H2O中Fe元素的化合价为。步骤①通常用热的纯碱溶液去除废铁屑表面的油脂效果较好,请结合平衡原理和离子方程式阐述其原理:。
-
(2) 为加快步骤②酸溶的速率,除升高温度外,还可以采取的措施有(任写一条),温度不宜高于100℃,否则将产生浓烈的刺激性气味,原因是生成了气体。
-
(3) 步骤③发生反应的离子方程式为。
-
(4) 表中数据为研究步骤③反应过程中溶液酸度对产品产量和反应速率的影响数据。pH过大,产品产率下降的可能原因为,最佳的pH控制范围为。
溶液酸度对硫酸铁铵产量和反应速率的影响
序号
溶液pH
反应时间/min
硫酸铁铵产量/g
硫酸铁铵产率/%
1
≤0.5
4.0
34.0
98.75
2
0.5~1.0
4.3
33.4
97.01
3
1.0~1.5
4.8
22.2
64.48
4
1.5~2.0
5.2
19.2
55.71
-
(5) 步骤⑤的具体操作有蒸发浓缩、、,经干燥得到硫酸铁铵晶体。
各物质间的转化关系如下图所示,请完成下列空白。
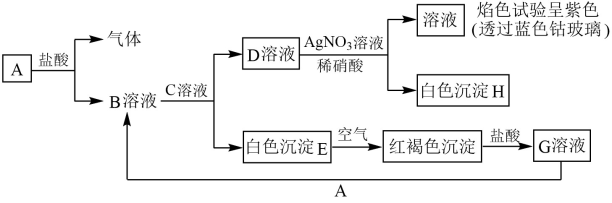
-
(1) 写出B和D的化学式: B;D。
-
(2) 写出E转变为F的化学方程式: 。
-
(3) 向G溶液中加入A,写出反应的离子方程式: 。
最近更新



