氯气的化学性质 知识点题库
-
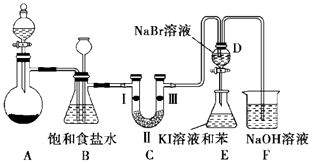
(1) 上述反应中是氧化剂,是还原剂,若反应中氧化产物比还原产物多 1mol,则转移的电子数目为.
-
(2) 装置B的作用是,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:.
-
(3) 装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入(选“a”“b”或“c”)
a
b
c
Ⅰ
干燥的有色布条
湿润的有色布条
湿润的有色布条
Ⅱ
碱石灰
浓硫酸
无水氯化钙
Ⅲ
湿润的有色布条
干燥的有色布条
干燥的有色布条
-
(4) 设计装置D、E 的目的是为了比较Cl2、Br2、I2的氧化性强弱. 已知Br2 的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶苯,且 I2 的苯溶液为紫红色.当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明 Cl2的氧化性大于 Br2 , 请写出D中对应的离子方程式并用双线桥法表示出电子转移情况:.打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象( 填“能”或“不能”)说明Br2的氧化性大于I2 .
-
(5) 装置F的作用是除去污染性的物质(Cl2、Br2 等),已知Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3 , 且
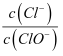 值与温度高低有关. 若烧杯中装有500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为 L(忽略Cl2溶于水).
值与温度高低有关. 若烧杯中装有500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为 L(忽略Cl2溶于水).
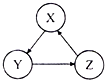
选项 | X | Y | Z |
A | Fe | FeCl3 | FeCl2 |
B | HCl | Cl2 | HClO |
C | S | SO3 | H2SO4 |
D | HNO3 | NO | NO2 |
-
(1) 将经过验纯的氢气点燃,伸入盛有氯气的集气瓶中,在集气瓶口可观察到的现象是
-
(2) 欲检验Na2CO3、Na2SO4、NaCl的混合溶液中的Cl﹣ , 正确的操作方法是
-
(3) 海水晒盐所获取的粗盐,经过提纯、精制之后,其水溶液进行电解,可以得到重要的化工原料.请写出该电解反应的离子方程式.海带中提取碘时,将海带烘干、灼烧目的是.
-
(4) 将0.01molCl2通入含0.03molNaBr和0.03molKI的混合液中,发生反应的离子方程式为
再将所得溶液分为两等份,其中一份蒸干、灼烧,最后得到的固体的成分一定有KCl,还有;另一份再加入少量CCl4 , 振荡,则CCl4层的颜色是,分离CCl4层和水层的操作名称是,需要使用的玻璃仪器除烧杯外,还有.
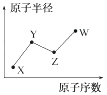
已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。请回答下列问题:
-
(1) 写出四种元素的元素符号:
W;X;Y;Z。
-
(2) 四种元素的所有化合价中,最低负化合价为价,最高正化合价为价。
-
(3) 甲和乙分别是由W、X、Y、Z四种元素中的三种元素组成的常见化合物,化合物甲具有消毒杀菌作用,其化学式为;化合物乙是一种常见的化肥,其化学式为。
-
(4) HYO3的酸性比HWO强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确,说明理由:。
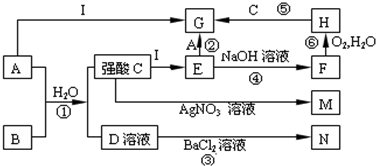
-
(1) 写出①的化学方程式。
-
(2) 写反应②的离子方程式。
-
(3) 写出将A通入石灰乳的化学方程式。
-
(4) 在①→⑥中,属于氧化还原反应的有(填编号)
-
(5) 将NaOH溶液加入到E中的现象为。
-
(6) 写出反应⑥的化学反应方程式。
-
(7) 写出分别将A、B通入石蕊试液中的现象:
AB。
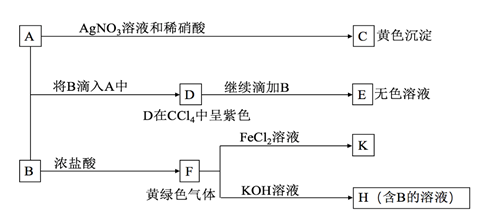
请回答:
-
(1) C的化学式为,检验气体F常用的试纸是
-
(2) 写出物质M在生活中的常见用途
-
(3) 写出F→H的化学方程式:
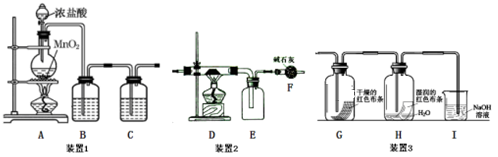
回答下列问题:
-
(1) 装置1是用来制备纯净、干燥的氯气:
①装置A中圆底烧瓶内发生反应的离子方程式是,反应中被氧化的HCl与消耗的HCl物质的量之比为。
②装置B内试剂为,装置C的作用是。
-
(2) ①若将装置1与装置2连接制备少量氯化铁固体(氯化铁易吸水,在300℃时升华),则:D中发生反应的化学方程式为。
②若在D装置的硬质玻璃管内装入石英沙和碳粉,则发生如下反应:SiO2+2C+2Cl2
 SiCl4+2CO。当反应消耗6g碳时,反应转移的电子数为,F装置之后还应添加一个装置用来。
SiCl4+2CO。当反应消耗6g碳时,反应转移的电子数为,F装置之后还应添加一个装置用来。 -
(3) 将装置1与装置3连接来探究氯气是否具有漂白性。
①将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是。
②为防止氯气尾气污染空气,根据氯水显酸性的性质,可用氢氧化钠溶液吸收多余的氯气,原理是(用离子方程式表示)。根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是(用字母代号填)。
A.O2 B.H2 C.CO2 D.HClO
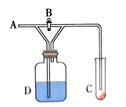
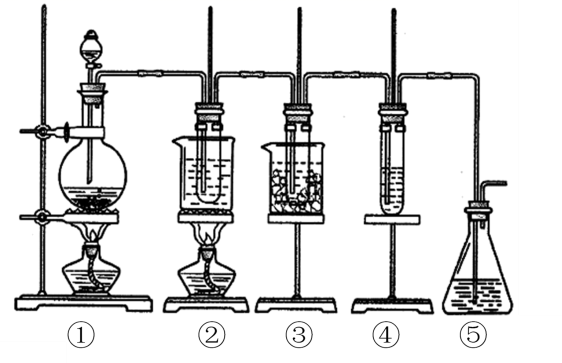
图中①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里盛有15mL 8%NaOH溶液,并置于冰水浴中;④的试管里加有几滴紫色石蕊试液;⑤为尾气吸收装置。
-
(1) 制取氯气时,在(填仪器名称)里加入一定量的二氧化锰,通过分液漏斗向其中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有的洗气瓶。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
-
(2) 比较制取氯酸钾和次氯酸钠的条件,两者的差别是。
-
(3) ①中制取氯气的化学方程式为;③中制取次氯酸钠的离子方程式为。
-
(4) 实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
实验现象
原因
溶液最初从紫色逐渐变为色
氯气与水反应生成的H+使石蕊变色
随后溶液逐渐变为无色
然后溶液从无色逐渐变为色
-
(5) ⑤为尾气处理装置,可选用的试剂____。A . 饱和食盐水 B . Na2S C . 高锰酸钾 D . Ca(OH)2
-
(1) 氯化亚铜(CuCl)是重要的化工原料,工业上常通过下列反应制备CuCl: 2CuSO4+Na2SO3+2NaCl+Na2CO3=2CuCl↓+3Na2SO4+CO2↑
查阅资料可得,CuCl可以溶解在FeCl3溶液中,请写出该反应的离子方程式。
-
(2) 已知:Cu2O在酸性溶液中发生歧化反应:Cu2O+2H+=Cu2++Cu+H2O。
现将一定量混合物(Fe2O3、Cu2O、CuCl、Fe)溶解于过量稀盐酸中,反应完全后,得到W(包括溶液和少量剩余固体)。
①继续往W中通入足量的氯气,不断搅拌,充分反应,溶液中哪些离子的物质的量一定有明显变化?(用离子符号表示)。
②不通入气体,改往W中加入过量铁粉,过滤,调pH约为7,加入淀粉-KI溶液和H2O2溶液,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是
-
(3) 某工厂废水中含KCN,其浓度为650 mg·L-1 , 现用氯氧化法处理,发生如下反应(化合物中N化合价均为-3) :KCN+2KOH+Cl2=KOCN+2KCl+H2O。
①通入过量氯气,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
_KOCN+_KOH+_ Cl2=_ CO2+_ N2+_KCl+_H2O。
②若将5 m3含KCN的浓度为650 mg·L-1的废水中KCN氧化成N2除去,需要标准状况下的氯气的体积为L。
-
(4) 二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理:2NaClO3+4HCl=2ClO2 ↑+Cl2↑+2H2O+2NaCl。
①该反应中,氧化剂和还原剂的物质的量之比为,依据氧化还原反应规律判断,氧化性强弱为NaClO3 (填“>"<"或“=")Cl2.。
②ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO
 ),需将其转化为Cl-除去,下列试剂中,可将ClO
),需将其转化为Cl-除去,下列试剂中,可将ClO  转化为Cl-的是 (填字母)。
转化为Cl-的是 (填字母)。A.FeSO4 B.O3 C.KMnO4 D.SO2
-
(5) 亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:
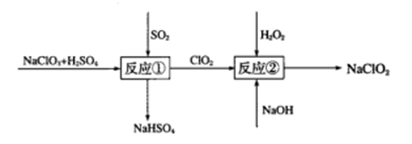
请将流程中反应②的离子方程式补充完整:
_ClO2+_H2O2+_=_ ClO
 + O2+_。
+ O2+_。



