氯气的化学性质 知识点题库
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | Cl2有漂白作用 | Cl2能使湿润的有色布条褪色 |
B | SiO2有导电性 | SiO2可用于制备光导纤维 |
C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
D | 浓氨汽化时要吸收大量的热 | 浓氨可用作制冷剂 |
①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;
②光照氯水有气泡逸出,该气体是Cl2;
③用米汤直接检验食用盐中是否含有碘元素;
④pH在5.6~7.0之间的降水通常称为酸雨;
⑤室温下浓硫酸与铜片不会发生剧烈的化学反应,原因是铜被钝化;
⑥氯气易液化,液氯可以保存在钢瓶中;
⑦常温下浓硫酸可以用铝制容器盛放;
⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤;
⑨蒸干AlCl3溶液可得纯净的无水氯化铝;
⑩滴入酚酞溶液确定纯碱中有无烧碱.
①将过氧化钠投入水中,然后加入几滴酚酞溶液,溶液先变红后褪色
②将活性炭放入红墨水中,溶液褪色
③向品红溶液中滴加氯水,红色褪去
④向酸性高锰酸钾溶液中通入二氧化硫气体,溶液紫色褪去

-
(1) 装置A中制取Cl2的化学方程式为。
-
(2) 装置C中发生反应的离子方程式为,反应后溶液中含Cl元素的分子有。
-
(3) 实验结束后,测得装置D溶液中存在大量SO42-。Cl2通过装置D溶液时发生反应的离子方程式为 。
-
(4) 装置F的作用是,该装置中发生反应的离子方程式。

相关信息如下:
a.四氯化硅接触水会发生化学反应;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
-
(1) 写出装置A中发生反应的离子方程式:,D中发生反应的化学方程式。
-
(2) A中g管的作用是,装置C中的试剂是,作用是。
-
(3) 装置E中的h瓶需要冷却的理由是。
-
(4) 装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是(填写元素符号)。
-
(5) 过量的氯气可以用石灰乳来处理,请写出该反应的化学方程式。
 B .
B .  C .
C .  D .
D . 
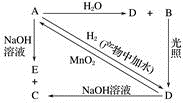
-
(1) 请分别写出下列物质的化学式(如为溶液请填溶质的化学式):A、B、D。
-
(2) 写出下列反应的化学方程式或离子方程式(请注明反应条件):A+H2O(离子方程式):;A+NaOH(离子方程式):;D→A(化学方程式):。
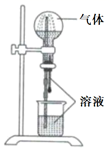
|
气体 |
溶液 |
|
|
A. |
H2S |
稀盐酸 |
|
B. |
HCl |
稀氨水 |
|
C. |
NO |
稀H2SO4 |
|
D. |
CO2 |
饱和NaHCO3溶液 |
 溶液不反应的是( )
溶液不反应的是( )
 和浓盐酸
B . Al与NaOH溶液
C . 浓硝酸和铜片
D . 铜片和浓硫酸共热
和浓盐酸
B . Al与NaOH溶液
C . 浓硝酸和铜片
D . 铜片和浓硫酸共热
方法Ⅰ NaClO + 2HCl(浓) = NaCl + Cl2↑ + H2O;
方法Ⅱ 4HCl(g) + O2(g) = 2H2O(g) + 2Cl2(g) ΔH = a kJ·mol−1
上述两种方法涉及的反应在一定条件下均能自发进行。利用方法Ⅰ制备Cl2时,下列装置能达到实验目的的是( )

 C . 用向下排空气法收集一瓶干燥而纯净的氯气
D . 将盛满氯气的试管倒扣在水槽中,检测其在水中的溶解性
C . 用向下排空气法收集一瓶干燥而纯净的氯气
D . 将盛满氯气的试管倒扣在水槽中,检测其在水中的溶解性
-
(1) 写出
 的电子式;
的电子式;
-
(2) 用电子式表示
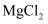 的形成过程;
的形成过程;
-
(3) 写出
 的结构式,它的空间构型为;
的结构式,它的空间构型为;
-
(4) 写出铜和浓硫酸反应的化学方程式;
-
(5) 写出实验室用
 代替
代替  制氯气的离子方程式。
制氯气的离子方程式。
 Al(OH)3(胶体)+3H+
D . 向AgI悬浊液中滴加Na2S溶液,沉淀变黑:2AgI(s)+S2-(aq)
Al(OH)3(胶体)+3H+
D . 向AgI悬浊液中滴加Na2S溶液,沉淀变黑:2AgI(s)+S2-(aq)  Ag2S(s)+2I-(aq)
Ag2S(s)+2I-(aq)
 , 且都能导电
D . 氯气化学性质活泼,在自然界中不存在游离态的氯元素
, 且都能导电
D . 氯气化学性质活泼,在自然界中不存在游离态的氯元素



