氯气的化学性质 知识点题库
氯气与二氧化硫都有漂白作用,若将等物质的量的这两种气体混合后通入品红的BaCl2的混合溶液,能观察到的现象是 ( )
①溶液很快退色 ②溶液不退色 ③出现沉淀 ④不出现沉淀
①溶液很快退色 ②溶液不退色 ③出现沉淀 ④不出现沉淀
A . ①②
B . ①③
C . ②③
D . ②④
下列物质的变化,不能通过一步化学反应完成的是( )
A . NO2→HNO3
B . Cl2→HClO
C . H2SO4(浓)→SO2
D . SiO2→H2SiO3
向NaBr、NaI、Na2SO3混合液中,通入一定量Cl2后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
A . NaCl、Na2SO3、Na2SO4
B . NaCl、NaBr、Na2SO4
C . NaCl、NaBr、I2
D . NaCl、NaI、Na2SO3
下列各组数据比较,前者比后者小的是( )
A . 氯水与氨水中微粒种类
B . 乙烷与苯分子中碳碳键键长
C . 氯化铯与氯化钠的熔点
D . Al2O3与AlCl3的熔点
根据所学知识完成题目:
-
(1) 写出下列反应的化学方程式:
①工业制漂白粉:;
②氯化亚铁溶液中通入氯气:.
-
(2) 写出下列反应的离子方程式:
③铁粉溶于稀硫酸:;
④稀硝酸与铜片的反应:.
下列实验过程中,溶液中始终无明显现象的是( )
A . NO2通入FeSO4溶液中
B . CO2通入NaAlO2溶液中
C . Cl2通入NaOH溶液中
D . SO2通入Na2SiO3溶液中
向某含有SO32﹣、SiO32﹣、CO32﹣、Br﹣、Na+的溶液中缓慢通入Cl2直至过量,下列对该反应过程的判断不正确的是( )
A . 整个过程共发生2个氧化还原反应
B . 所有阴离子的浓度都发生了变化
C . 溶液的颜色发生了变化
D . 反应过程中既有气体产生,也有沉淀产生
某同学设计的制取氯气和验证氯气部分化学性质的实验装置如图所示:

其中D处放有干燥的紫色石蕊试纸,E处放有湿润的紫色石蕊试纸,F、G处依次放有喷上少量淀粉KI溶液、浓NaOH溶液的棉球.回答下列问题:
-
(1) 在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,请写出A处反应的化学方程式:;
-
(2) B处饱和食盐水是为了除去.
-
(3) 在E处,紫色石蕊纸的颜色由紫色变为红色,再变为无色,其原因是.
-
(4) 当F处棉球变色,立即关闭活塞K,可看到I瓶中液面上升,H瓶中充满黄绿色气体.则甲装置的作用为.
-
(5) G处可能发生反应的化学方程式.
下列检验方法不合理的是( )
| 选项 | 实验 | 检验方法 |
| A | 向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,得Fe(OH)3胶体 | 用激光笔照射烧杯中的液体 |
| B | 证明溶液中存在NH4+ | 滴加浓NaOH溶液,加热,将湿润的红色石蕊试纸置于试管口,试纸变蓝 |
| C | 区分AgNO3溶液和Al2(SO4)3溶液 | 分别取少量溶液,滴加BaCl2溶液 |
| D | 证明氯水中起漂白作用的不是Cl2 | 用CCl4充分萃取,将红纸条分别浸入分层后的溶液中 |
A . A
B . B
C . C
D . D
用如图的实验装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
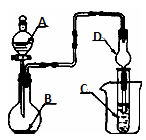
A . 若A为浓盐酸,B为MnO2 , C中盛品红溶液,则C中溶液褪色
B . 若A为稀盐酸,B为石灰石,C中盛CaCl2溶液,则C中溶液变浑浊
C . 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D . 若A为浓硝酸,B为铜屑,C中盛紫色石蕊溶液,则C中溶液变红色
有关铁铜的说法正确的是( )
A . 用铜制容器可以运输浓硝酸和浓硫酸
B . 铜与过量的硫粉共热产物是Cu2S
C . Fe2O3与NaOH溶液反应可制取Fe(OH)3
D . Fe在足量Cl2中燃烧生成FeCl3 , 在少量Cl2中燃烧生成FeCl2
下列说法正确的是( )
A . 钠在空气中燃烧只生成白色固体
B . 钠在氯气中燃烧呈现苍白色火焰
C . SO2使紫色石蕊试液先变红后褪色
D . 铜在氯气中燃烧生成棕黄色烟
下列关于氯水的叙述中正确的是( )
A . 新制氯水中只含有Cl2和H2O两种分子
B . 新制氯水可以使蓝色石蕊试纸先变红后褪色
C . 氯气、液氯和氯水是同一种物质
D . 氯水放置数天后pH变大
为了验证氯气的氧化性,将氯气分别通入①KI溶液、②H2S溶液、③FeBr2溶液中:
-
(1) 如果要将①中反应后的单质氧化产物从水溶液中分离,需先进行(填操作名称),然后进行分液即可;
-
(2) 溶液②中出现淡黄色的沉淀,且反应后溶液呈强酸性,试写出反应的化学方程式;
-
(3) 反应③进行一段时间后振荡,溶液呈黄色,罗同学提出溶液变色的原因可能生成Br2 或Fe3+ , 请问他该如何通过实验确认生成Br2(限选用的试剂有:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硝酸银溶液、淀粉—碘化钾溶液);如果生成的是Fe3+ , 请写出反应的离子方程式:;
-
(4) 已知:
Ⅰ.氧化性Cl2>HIO3>Br2>Fe3+>I2
Ⅱ.2Fe3++2I-=2Fe2++I2
将FeBr2、FeI2和HBr(强酸)溶于水,往溶液中通入过量Cl2 , 各反应或生成的微粒随氯气通入量的变化如下图所示

请回答:
①通过实验如何证明ab段反应已开始进行;
②c点之前溶液中的阴离子总物质的量最大时为mol;
③cd段发生反应的化学方程式为。
通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是( )
A . HCl
B . Cl2
C . NH3
D . N2
下列实验现象描述错误的是( )
A . 氢气在氯气中燃烧,火焰呈苍白色
B . 钠在氯气中燃烧火焰呈黄色
C . 铁丝在氯气中燃烧时产生棕褐色烟雾
D . 氯气的水溶液呈浅黄绿色
-
(1) Ⅰ.工业上常用氯气与石灰乳反应制漂白粉,但Ca(OH)2与Cl2反应的氧化产物与温度有关。在足量的石灰乳中通入一定量的氯气,充分反应后生成Cl-、ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。

常温时工业制漂白粉的化学方程式为。
-
(2) t1时开始有ClO3-生成的原因是。
-
(3) 该石灰乳中参加反应的Ca(OH)2的物质的量是mol(用含a的代数式来表示)。
-
(4) Ⅱ.过氧乙酸(
 )是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。 下列叙述正确的是_________________(填字母)。
A . 过氧乙酸分子中两个氧原子化合价为-1,一个氧原子化合价为-2 B . 过氧乙酸溶于水能导电,属于离子化合物,也属于电解质 C . 过氧乙酸包装上应贴的危险警告标签应如图所示 D . 过氧乙酸应注意密闭、低温保存于棕色细口瓶中
E . 过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
D . 过氧乙酸应注意密闭、低温保存于棕色细口瓶中
E . 过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
-
(5) 某学生在实验室用3.00 mol•L−1过氧乙酸配制0.15 mol•L−1过氧乙酸溶液250 mL,该生用量筒量取工业品过氧乙酸的体积为mL。
-
(6) 如果生产过氧乙酸的原料CH3COONa中混有了SO42- , 要想除掉SO42- , 请选择下列试剂按照加入先后顺序填空(试剂不必选完,填序号)。
①醋酸钡溶液;②醋酸;③硝酸钡溶液;④盐酸;⑤碳酸氢钠溶液;⑥碳酸钠溶液。
下列离子方程式中,正确的是( )
A . Fe3+的检验:Fe3++3KSCN═Fe(SCN)3+3K+
B . 氯气用于自来水消毒:Cl2+H2O═H++Cl-+HClO
C . 证明H2O2具有还原性:2MnO4-+6H++3H2O2═2Mn2++4O2↑+6H2O
D . 用CuCl2溶液做导电性实验,灯泡发光:CuCl2  Cu2++2Cl-
Cu2++2Cl-
 Cu2++2Cl-
Cu2++2Cl-
下列关于Cl2性质的说法正确的是( )
A . 可与NaOH溶液反应
B . 是无色无味的气体
C . 能使干燥的有色布条褪色
D . 密度比空气小
化学与生产、生活密切相关,下列物质的性质、用途都正确且有相关性的是( )
|
选项 |
性质 |
用途 |
|
A |
CCl4难溶于水,难于燃烧 |
CCl4常用作有机溶剂和灭火剂 |
|
B |
Al2O3既能与强酸反应,又能与强碱反应 |
Al2O3常用作耐高温材料 |
|
C |
SiO2透明,折射率合适,能够发生全反射 |
SiO2用作光导纤维材料 |
|
D |
Cl2具有漂白性 |
常用Cl2对自来水进行杀菌消毒 |
A . A
B . B
C . C
D . D
最近更新



