氯、溴、碘及其化合物的综合应用 知识点题库
氯元素是生产生活中常见的非金属元素
-
(1) 将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式: ;不直接用Cl2作漂白剂的原因是 (写出两条).
-
(2) 使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物.下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号).
a.臭氧 b.NH3 c.明矾 d.ClO2
-
(3) 生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀.
①NaCl和Cl2中化学键的类型分别是 和 .
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2 . 若生成Cl2 22.4L(标况)时转移电子数为4×6.02×1023 , 该反应的化学方程式是
③已知:
2H2O2(l)═2H2O(l)+O2(g)△H1=﹣196.46kJ•mol﹣1
H2(g)+O2(g)═H2O(l)△H2=﹣285.84kJ•mol﹣1
Cl2(g)+H2(g)═2HCl(g)△H3=﹣184.60kJ•mol﹣1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2 . 依据上述已知反应,写出该反应的热化学方程式:
下列叙述中正确的是( )
A . 漂白粉中的有效成分为次氯酸钙,在空气中可以长时间放置而不变质
B . 二氧化硅是将太阳能转变为电能的常用材料
C . 美国纽约冬季城市供暖使用的主要能源是天然气,天然气属于不可再生能源
D . 虎门销烟中用到了大量的生石灰,将生石灰投入销烟池的海水中,海水开始翻腾,这是一个物理变化
ICl3遇水会产生大量的腐蚀性白色浓雾,有强烈的催泪性.若两种生成物之一是HCl,则另一种是( )
A . HIO3
B . HIO2
C . HIO
D . ICl
类比推理是化学学习中的一种重要方法.下列类推结论中,正确的是( )
类比对象 | 结论 | |
A. | Cl2+H2O═HCl+HClO | I2+H2O═HI+HIO |
B. | Cl2+2Fe2+═2Fe3++2Cl﹣ | I2+2Fe2+═2Fe3++2I﹣ |
C. | S+Fe═FeS | S+Cu═CuS |
D. | Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O ═CaSO3↓+2HClO |
A . A
B . B
C . C
D . D
氯仿(CHCl3 , 非电解质)在空气中能发生缓慢氧化,生成剧毒物质光气(COCl2 , 非电解质),化学方程式为2CHCl3+O2═2COCl2+2HCl.检验氯仿是否被氧化应选用的试剂是( )
A . 水
B . 硝酸酸化的硝酸银溶液
C . 酚酞溶液
D . 氢氧化钠溶液
化学与生活、生产密切相关.下列叙述不正确的是( )
A . “血液透析”利用了胶体的性质
B . 铜盐溶液都有毒,Cu2+能使蛋白质变性
C . 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料
D . 漂白液的有效成分为CaCl2和Ca(ClO)2
将CO2通入下列物质的溶液中不与其反应的是( )
①Na2CO3②Ca(ClO)2③CaCO3④CaCl2 .
A . ①③④
B . ①和③
C . 只有②
D . 只有④
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为;漂白粉的有效成分是(填化学式).该反应中氧化剂与还原剂物质的量之比是.
下列关于漂白粉的叙述正确的是( )
A . 漂白粉的有效成分是Ca(ClO)2和CaCl2
B . 漂白粉在空气中久置后会变质
C . 漂白粉是由Cl2与烧碱制得的
D . 在使用漂白粉时应用浓盐酸
如图中,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.
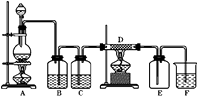
-
(1) 上述装置中有一处错误,请指出是处(用字母表示).
-
(2) 通过B是为了除去,在B中应加入;通过C是为了除去
-
(3) 写出D中发生反应的化学方程式, 并用单线桥标出的电子转移的方向和数目
-
(4) 写出F中发生反应的离子方程式
-
(5) 如果A中产生氯气3.36L(标准状况),请计算:
①写出A中发生反应的化学方程式,并用双线桥标出A中的电子得失情况
②消耗MnO2的物质的量
③该实验中转移电子数为
下列关于常见物质的用途说法不正确的是( )
A . 金属钠具有强还原性,可以用来置换TiCl4中的Ti
B . 二氧化氯具有强氧化性,可以用来漂白织物
C . 碳酸钡可用于肠胃X射线造影检查
D . 氢氧化铁胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,因而可以净水
将足量氯气通入KBr和KI混合溶液中,反应后蒸干溶液、灼烧,残留物是( )
A . KCl
B . KCl和KBr
C . KCl和KI
D . KCl、Br2和I2
下列对氯及其化合物的说法正确的是( )
A . 过量的铁在氯气中燃烧时生成FeCl2
B . 用pH试纸测得氯水的pH=4
C . 液溴易挥发,盛放在用水液封的棕色广口试剂瓶中
D . 氯水、氯气、液氯均能与硝酸银溶液反应产生白色沉淀
ClO2是一种新型水处理剂,工业上用NaClO2与盐酸反应制备ClO2的反应如下:
①5NaClO2+4HCl(稀)=5NaCl+4ClO2↑+2H2O;
②NaClO2+4HCl(浓)=NaCl+2Cl2↑+2H2O。
下列说法中正确的是( )
A . 两种反应中HCl均是还原剂
B . 盐酸浓度越大,还原性越强
C . ①中氧化产物与还原产物物质的量之比为4∶5
D . ②中每生成1 mol Cl2转移2 mol电子
下列说法正确的是( )
A . 可用碘水检验淀粉是否水解完全
B . 油脂都不能使溴水褪色
C . 葡萄糖、果糖和蔗糖都能发生水解反应
D . 糖类、油脂、蛋白质都是由C,H,O三种元素组成的
海水是巨大的资源宝库,从海水中可以提取食盐、溴,还可以制得金属镁等,下图是制取原理流程图:
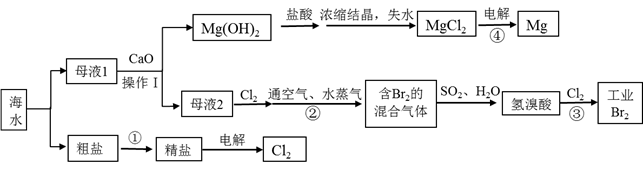
回答下列问题:
-
(1) 操作1的名称是。
-
(2) 步骤①除去粗盐中的杂质(Mg2+、
 、Ca2+),加入药品顺序正确的是_______________。
A . NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 B . BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸. C . NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸 D . Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
、Ca2+),加入药品顺序正确的是_______________。
A . NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 B . BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸. C . NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸 D . Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 -
(3) 步骤②中空气与水蒸气的作用是。步骤②中已获得Br2 , 步骤③中又将Br2还原成Br- , 其目的是。
-
(4) 写出步骤③的离子反应方程式。
-
(5) 写出步骤④的化学反应方程式,下列物质可以用作镁蒸气的冷却剂的是。
A.空气 B.Ar C.CO2
向溴水中加入或通入足量下列物质,最终不能得到无色溶液的是( )
A . 二氧化硫
B . 氢氧化钠溶液
C . 碘化钾溶液
D . 热空气
下列关于新冠病毒说法不正确的是( )
A . 含有病毒的飞沫分散在空气中形成的分散系为气溶胶
B . N95口罩所使用的聚丙烯材料属于天然纤维
C . 用于盛装新冠疫苗的中硼硅玻璃管属于硅酸盐材质,既耐低温,又耐强酸
D . 用电解食盐水制取的次氯酸钠喷洒房间能杀死新冠肺炎病毒
对于液溴和溴水的混合物, 下列叙述述正确的是( )
A . 取上层液体和苯在催化剂作用下制溴苯
B . 液溴呈紫色, 在上层
C . 液溴呈深红棕色, 在下层
D . 混合物存放在带橡皮塞的细口瓶中
下列钠的化合物的性质与用途具有对应关系的是( )
A .  易溶于水,可用于工业电解制备钠
B .
易溶于水,可用于工业电解制备钠
B .  有强氧化性,可用于消毒杀菌
C .
有强氧化性,可用于消毒杀菌
C .  有还原性,可用于漂白纸浆
D .
有还原性,可用于漂白纸浆
D .  受热易分解,可用于制胃酸中和剂
受热易分解,可用于制胃酸中和剂
 易溶于水,可用于工业电解制备钠
B .
易溶于水,可用于工业电解制备钠
B .  有强氧化性,可用于消毒杀菌
C .
有强氧化性,可用于消毒杀菌
C .  有还原性,可用于漂白纸浆
D .
有还原性,可用于漂白纸浆
D .  受热易分解,可用于制胃酸中和剂
受热易分解,可用于制胃酸中和剂
最近更新



