氯、溴、碘及其化合物的综合应用 知识点题库
浩瀚的海洋中蕴藏着丰富的资源,其中可以为人类利用的氯化物含量相当高.海水中含量最多的氯化物是( )
A . NaCl
B . MgCl2
C . KCl
D . CaCl2
潮湿的氯气、新制的氯水、次氯酸钠、漂白粉溶液均能使有色布条褪色这是由于它们含有或能生成( )
A . 氯气
B . 次氯酸
C . 次氯酸根
D . 氯化氢
H1N1病毒是一种没有超常抵抗力的病毒.研究证明,许多常用消毒药物如漂粉精、漂白粉、高锰酸钾等,可以将H1N1病毒杀灭.
-
(1) 工业上制取漂白粉的反应方程式为.
-
(2) 将漂白粉溶于适量水中,呈白色浊状物,静置沉降.取少许上层清液,滴加碳酸钠溶液出现白色沉淀,写出其中一个化学方程式.
另取少许上层清液,滴加适量的(填化学式)即可检验Cl﹣的存在,发生反应的化学方程式为.
-
(3) 漂白粉在空气中长期放置,会失效,用化学方程式解释其原因.
写出工业上制备漂白粉的化学方程式.
下列关于漂白粉的叙述不正确的是( )
A . 漂白粉的有效成分是Ca(ClO)2
B . 漂白粉暴露在空气中久置后能变质
C . 漂白粉是由Cl2与石灰乳制得
D . 在使用漂白粉时应用浓盐酸
下列物质久置空气中不会变质的是( )
A . 亚硫酸钠固体
B . 漂白粉固体
C . 过氧化钠粉末
D . 硫酸钠粉末
某炼金厂的废水因连降暴雨而溢出,导致河水严重污染,炼金废水中所含CN﹣有剧毒,其性质与卤素离子相似,还原性介于I﹣与Br﹣之间,HCN为弱酸.下列说法不正确的是( )
A . CN﹣可以和稀硫酸反应生成HCN
B . CN﹣可被Cl2氧化成(CN)2
C . 在水溶液中(CN)2不能将F﹣氧化
D . HCN的电子式为 
下列有关氯及其化合物的说法正确的是( )
A . 常温下干燥的Cl2可储存于钢瓶,说明Cl2不与铁反应
B . 电解饱和氯化钠溶液可得到氯气、氢气和钠
C . 工业上以氯气和澄清石灰水为原料制取漂白粉
D . 次氯酸能使染料等有机色素褪色,有漂白性,还能杀死水中的细菌,起消毒作用
下列关于卤族元素(X)及其化合物叙述错误的是( )
A . 单质均有颜色,随原子序数递增颜色加深
B . HX随原子序数递增稳定性逐渐减弱
C . 单质(除F2)均能与水反应形成HX和HXO,HXO的结构式为:H﹣X﹣O
D . HX中除HF分子间存在氢键,其余HX分子均不存在氢键
自来水是用适量氯气杀菌消毒过的.不法商贩常用自来水冒充纯净水谋取暴利,可用化学试剂鉴别真伪,该试剂可以是( )
A . 酚酞试液
B . 氯化钡溶液
C . 氢氧化钠溶液
D . 硝酸银溶液
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2+4HCl(浓) 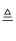 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
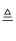 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
-
(1) 在该反应中,如有1mol Cl2生成,被氧化的HCl的物质的量是mol,转移电子的物质的量是mol.
-
(2) 报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你的化学知识分析,原因是(用离子方程式表示).
下列各步反应A(HCl)→B(Cl2)→C(NaClO)→D(HClO)→E(CO2),其中不能直接一步实现的是( )
A . A→B
B . B→C
C . C→D
D . D→E
下列物质中,能使淀粉碘化钾溶液变蓝的是( )
A . 氨水
B . 溴水
C . 苏打水
D . 食盐水
阅读以下信息:①向盛有10mL水的锥形瓶中,小心滴加8~10滴 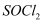 液体,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体中含有可使品红溶液褪色的
液体,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体中含有可使品红溶液褪色的  ;②蒸干
;②蒸干  溶液不能得到无水
溶液不能得到无水  ,使
,使 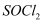 与
与  混合并加热,可得到无水
混合并加热,可得到无水  。请回答:
。请回答:
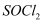 液体,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体中含有可使品红溶液褪色的
液体,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体中含有可使品红溶液褪色的  ;②蒸干
;②蒸干  溶液不能得到无水
溶液不能得到无水  ,使
,使 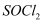 与
与  混合并加热,可得到无水
混合并加热,可得到无水  。请回答:
。请回答:
-
(1) 将①中发生反应的化学方程式补充完整:SOCl2+H2O=SO2↑+;
-
(2)
 溶液呈(填“酸”“碱”或“中”)性,用离子方程式表示其原理为:。
溶液呈(填“酸”“碱”或“中”)性,用离子方程式表示其原理为:。
-
(3) 试解释②中可得到无水
 的原因:。
的原因:。
海水是巨大的化学资源宝库,利用海水可以获取很多物质。海水中主要离子有Na+、K+、Ca2+、Mg2+、Cl-、SO42-等。
利用1:淡水工业
-
(1) 海水淡化的方法主要有、电渗析法、离子交换法等。
-
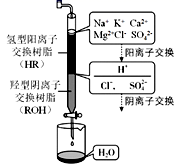
(2) 电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。

①淡水在室(填X、Y或Z)形成后流出。
②一般海水不直接通入到阴极室中,原因是。
-
(3) 离子交换法净化海水模拟过程如图所示,氢型阳离子交换原理可表示为:HR+Na+=NaR+H+ , ……。羟型阴离子交换树脂填充段存在的反应有。
利用2:提溴工业
-
(4) 用海水晒盐之后的盐卤可提取溴,提取流程如图:

①用热空气将溴赶出,在吸收塔先用浓Na2CO3溶液吸收Br2 , Br2歧化为Br-和BrO3- , 再加入W溶液得到Br2。推测W是。
②蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是。
③将1m3海水浓缩至1L,使用该法最终得到38.4gBr2 , 若总提取率为60%,则原海水中溴的浓度是 mg/L。
ClO2广泛用于水处理、纸浆漂白等。
-
(1) 制备ClO2原料有NaClO2等,产生的ClO2(g)用蒸馏水吸收得到吸收液A。
①ClO2中氯元素的化合价为。
②NaClO2与盐酸在微热条件下生成ClO2气体(及少量副产物Cl2),写出其反应生成ClO2、NaCl和水的化学方程式:。
-
(2) 碘量法测定ClO2吸收液A中ClO2和Cl2的浓度的主要实验步骤如下:
步骤1.向锥形瓶中加入50mL蒸馏水、25mL100g·L-1KI溶液(足量),再向其中加入5.00mLClO2吸收液(发生反应:2ClO2+2KI=2KClO2+I2 , Cl2+2KI=2KCl+I2)。
步骤2.用0.1000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至浅黄色,再加入1mL淀粉溶液,继续滴定至蓝色刚好消失,消耗Na2S2O3溶液6.00mL。
步骤3.向步骤2的溶液中加入5mL2mol·L-1硫酸溶液酸化,发生反应:KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O。
步骤4.重复步骤2操作,第二次滴定又消耗0.1000mol·L-1Na2S2O3溶液20.00mL。
根据上述数据,计算ClO2吸收液A中ClO2和Cl2的浓度(单位g·L-1 , 写出计算过程)。
海水开发利用的部分过程如图所示,下列有关说法正确的是( )
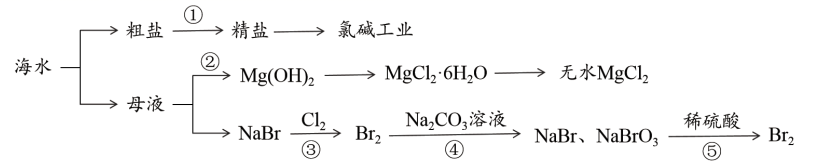
A . 除去粗盐中的Ca2+、Mg2+、 , 加入试剂的顺序是:Na2CO3→NaOH→BaCl2→过滤后加盐酸
B . 步骤②在工业生产中常选用石灰乳作Mg2+的沉淀剂
C . 第④步反应中氧化产物与还原产物的物质的量之比为5:1
D . 第⑤步反应的离子方程式为:
, 加入试剂的顺序是:Na2CO3→NaOH→BaCl2→过滤后加盐酸
B . 步骤②在工业生产中常选用石灰乳作Mg2+的沉淀剂
C . 第④步反应中氧化产物与还原产物的物质的量之比为5:1
D . 第⑤步反应的离子方程式为:
 , 加入试剂的顺序是:Na2CO3→NaOH→BaCl2→过滤后加盐酸
B . 步骤②在工业生产中常选用石灰乳作Mg2+的沉淀剂
C . 第④步反应中氧化产物与还原产物的物质的量之比为5:1
D . 第⑤步反应的离子方程式为:
, 加入试剂的顺序是:Na2CO3→NaOH→BaCl2→过滤后加盐酸
B . 步骤②在工业生产中常选用石灰乳作Mg2+的沉淀剂
C . 第④步反应中氧化产物与还原产物的物质的量之比为5:1
D . 第⑤步反应的离子方程式为:
-
(1) ①写出漂白粉有效成分的化学式。
②写出1,2-二溴乙烷的结构简式。
-
(2) 写出四氧化三铁与稀盐酸反应的化学方程式。
碘及其化合物广泛用于医药、染料等方面。一种制备方法如图所示,下列有关说法正确的是:( )
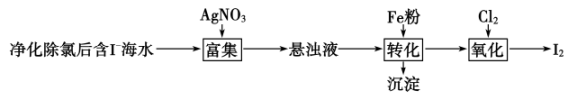
A . 整个流程中涉及的化学反应类型均为氧化还原反应
B . 转化中生成的沉淀与硝酸反应的产物可循环使用
C . 通入 后,若氧化产物只有一种,反应的化学方程式为:
后,若氧化产物只有一种,反应的化学方程式为: 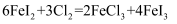 D . 过量
D . 过量 会将
会将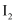 氧化为
氧化为 , 其反应的离子方程式为:
, 其反应的离子方程式为: 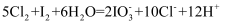
 后,若氧化产物只有一种,反应的化学方程式为:
后,若氧化产物只有一种,反应的化学方程式为: 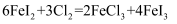 D . 过量
D . 过量 会将
会将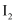 氧化为
氧化为 , 其反应的离子方程式为:
, 其反应的离子方程式为: 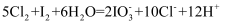
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法错误的是( )
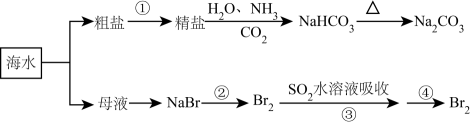
A . 在第②③④步骤中,溴元素均被氧化
B . 侯氏制碱过程中应先通 再通
再通 C . 制取
C . 制取 的反应是利用其溶解度小于NaCl
D . ③④的目的是进行溴的富集
的反应是利用其溶解度小于NaCl
D . ③④的目的是进行溴的富集
 再通
再通 C . 制取
C . 制取 的反应是利用其溶解度小于NaCl
D . ③④的目的是进行溴的富集
的反应是利用其溶解度小于NaCl
D . ③④的目的是进行溴的富集
最近更新



