氯、溴、碘的性质实验 知识点题库
已知下列物质的氧化性:KMnO4>Cl2>Fe3+>I2 . 某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)来验证:
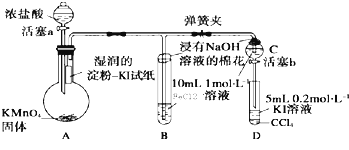
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液由浅绿色变为黄色时,夹紧弹簧夹.
Ⅲ.…
试回答下列问题:
(1)A中产生氯气的化学方程式
(2)由湿润的淀粉﹣KI试纸变蓝的现象得出的结论是
(3)写出步骤II 结束后检验B中阳离子的试剂: 现象: .
A.打开活塞b,振荡D试管、静止后可以观察到的现象是
B.在100mLFeI2溶液中通入2.24LCl2(标准状况),溶液中有 的I﹣被氧化成单质I2 , 则原FeI2溶液中FeI2的物质的量浓度为 .
的I﹣被氧化成单质I2 , 则原FeI2溶液中FeI2的物质的量浓度为 .
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2 , 上述现象不是化学反应所致,溶液呈黄色是Br2所致.
②乙同学认为氧化性:Br2>Fe3+ , 上述现象是发生化学反应所致,溶液呈黄色是Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
A.酚酞试液 B.CCl4 C.无水酒精 D.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
选用试剂 | 实验现象 | |
方案1 | ① | ② |
方案2 | ③ | ④ |
(4)应用与拓展
在足量的稀氯化亚铁溶液中加入1~2滴溴水,溶液呈黄色,所发生的离子反应方程式为: .
某校化学小组设计如图的装置制备氯气并探究氯气的某些化学性质:

(1)欲利用浓盐酸与B不加热制取氯气,则B可选用下列物质中的 ;
a.MnO2 b.Ca(ClO)2 c.KMnO4 d.NaCl
(2)C装置的作用是 ;C中加入 溶液;当C后面的装置发生堵塞时,C中的现象是: .
(3)装置D用于验证氯气的漂白性,①是③是
(4)为探究氯气与Fe反应的产物与氯气通入量的关系,设计实验,并记录现象如下:
实验方法 | 实验现象 | 实验结论 |
1.取反应初始阶段(氯气不足量)E中产物,用磁铁除去过量的Fe,剩余产物溶于水中,取上层溶液,①加入KSCN溶液,②加入KMnO4溶液 | ① ② | 生成物中没有FeCl2 生成物中含有FeCl3 |
2.取充分反应后(氯气通入足够长时间)E中产物,溶于水中,加入KMnO4溶液 |
根据实验结论,氯气与Fe粉共热时发生反应的化学方程式: .
为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验).
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.…
(1)A中产生黄绿色气体,其电子式是 .
(2)验证氯气的氧化性强于碘的实验现象是 .
(3)B中溶液发生反应的离子方程式是 .
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 .
(5)过程Ⅲ实验的目的是 .
(6)结论:氯、溴、碘单质的氧化性逐渐 .
分析:因为主族元素从上到下原子半径逐渐 , 得电子能力逐渐

-
(1) 提出问题:Fe3+、Br2哪个氧化性更强?
猜想:①甲同学认为氧化性:Fe3+>Br2 , 故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+ , 故上述现象是发生氧化还原反应所致,则溶液呈黄色是含所致.
-
(2) 设计实验并验证丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的.
供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液.
请你在表中写出丙同学选用的试剂及实验中观察到得现象.
选用试剂(填序号)
实验现象
方案1
方案2
-
(3) 结论
氧化性:Br2>Fe3+ . 故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为.
-
(4) 实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有
 的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为.
的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为.
⑴提出问题:Fe3+、Br2哪个氧化性更强?
⑵猜想:①甲同学认为氧化性:Fe3+>Br2 , 故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+ , 故上述现象是发生氧化还原反应所致,则溶液呈黄色是含所致.
⑶设计实验并验证丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的.
供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液.
请你在表中写出丙同学选用的试剂及实验中观察到得现象.
选用试剂(填序号) | 实验现象 | |
方案1 | ||
方案2 |
⑷结论
氧化性:Br2>Fe3+ . 故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为.
⑸实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有  的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为.
的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为.
-
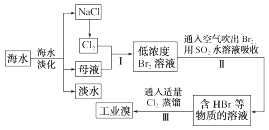
(1) 请写出一种海水淡化的方法:。
-
(2) 步骤Ⅰ获取Br2的离子方程式为。
-
(3) 步骤Ⅱ用SO2水溶液吸收Br2 , 使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,还原剂是(填化学式)。若反应中生成4 mol HBr,则消耗mol SO2。

乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
水溶性 | 易溶 | 难溶 | 微溶 |
-
(1) 加热A中三种反应物的混合物时,发生反应的化学方程式为:。
-
(2) 若选用较浓的硫酸作为反应物,得到的产品则会呈棕黄色,这说明反应过程中有生成。为去除颜色,最好选择下列的溶液来洗涤产品。
A.四氯化碳
B.硫酸钠
C.碘化亚铁
D.亚硫酸钠
产品选择上述溶液洗涤后,还需再用蒸馏水洗涤一次。洗涤液与产品分离的方法是(填方法名称)。
-
(3) 装置中,B和D两部分的作用分别是:B ;D。
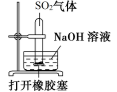 证明SO2易溶于水
B .
证明SO2易溶于水
B .  除去氯气中的HCl杂质
C .
除去氯气中的HCl杂质
C . 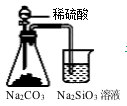 证明碳酸酸性强于硅酸
D .
证明碳酸酸性强于硅酸
D . 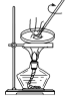 蒸发溴水获取溴单质
蒸发溴水获取溴单质
-
(1) 随原子序数的递增,八种短周期元素x、y、z、d、e、f、g、h原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答下列问题:
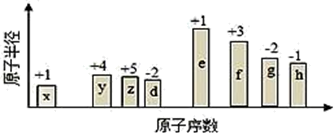
① 比较y、z、d的气态氢化物的稳定性强弱是:>>(用化学式表示)
② 由表中两种元素的原子按1:1组成的化合物A,A中既含离子键又含非极性共价键,其电子式为;
③ 下列四种元素的原子序数如下,其中不是和f同一主族的是
a.5
b. 21
c. 49
d. 81
④能表示出g和h元素非金属性强弱的离子方程式是;能表示出y和h最高价氧化物的水化物的酸性强弱的离子方程式是。
-
(2) F、Cl、Br、I位于周期表的VIIA族。通过下列实验比较出卤族氧化性的强弱。实验如下:

①通过卤素间置换反应比较氧化性强弱的实验是。(填写1、2、3、4)
②滴加CCl4的目的是。
③上述实验能否说明氯的氧化性强于溴?判断并说明你的依据。
 夹持装置未画出、I2固体易升华
夹持装置未画出、I2固体易升华  的说法正确的是( )
的说法正确的是( ) 
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3 , 充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
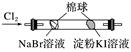
| B | | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 浓HNO3加热 | 有红棕色气体产生 | HNO3有强氧化性 |
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液中 | 证明 SO2具有氧化性 |
| B | 将Cl2通入NaBr溶液中 | 比较氯与溴的氧化性强弱 |
| C | 用盐酸与右灰石反应,将生成的气体直接通入硅酸钠溶液中 | 比较碳酸、硅酸的酸性强弱 |
| D | 将湿润的蓝色石蕊试纸放在集气瓶瓶口 | 证明 NH3已经收集满 |

已知:①3Br2+3CO 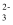 = 5Br- +BrO
= 5Br- +BrO  +3CO2↑②5Br- +BrO
+3CO2↑②5Br- +BrO  +6H+ =3Br2 +3H2O
+6H+ =3Br2 +3H2O
下列说法错误的是( )

下列说法错误的是( )
-
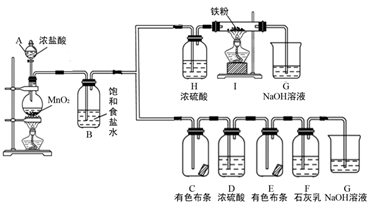
(1) 仪器A的名称为;B中饱和食盐水的作用是。
-
(2) 请写出二氧化锰与浓盐酸反应的化学方程式。
-
(3) 广口瓶C、E中的有色布条褪色的是(填“C”或“E”)。
-
(4) 装置F可用于制漂白粉,漂白粉的有效成分是________。A . Ca(OH)2 B . Ca(ClO)2 C . CaCl2 D . Ca(ClO)2和CaCl2
-
(5) 烧杯G的作用是处理尾气。请写出G中反应的离子方程式。
-
(6) 检验G中阳离子的方法是;检验I中阳离子的试剂是(填化学式),现象为。
操作 | 实验现象 | 结论 | |
A | 向NaBr溶液中加入过量氯水,再加入淀粉—KI溶液 | 溶液变蓝 | 非金属性:Cl>Br>I |
B | B向某无色溶液中滴加浓盐酸 | 产生气体能使品红溶液褪色 | 原溶液中不一定含有SO |
C | 向酸性KMnO4溶液中滴加较浓FeCl2溶液 | 溶液紫色褪去 | Fe2+有还原性 |
D | 在相同温度下,向1mL0.2mol·L-1NaOH溶液中滴入2滴0.1mol·L-1MgCl2溶液,再滴加2滴0.1mol·L-1CuSO4溶液 | 先产生白色沉淀后出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |

请回答下列问题:
-
(1) 仪器b的名称是。
-
(2) 装置A中导管a的作用是。
-
(3) 若装置发生堵塞,则装置B中可以观察到的现象是。
-
(4) 该实验装置中能说明Cl原子的得电子能力比Br原子的强的离子方程式为。
-
(5) 装置D中进行的实验存在的明显不足之处是(答一点)。
-
(6) 溶液X可能是。
 或HSO
或HSO



