氯、溴、碘的性质实验 知识点题库
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反得到固体物质的成分.
(1)A中制取Cl2的离子方程式 .
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究.
①提出合理假设.
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 .
②设计方案,进行实验.写出实验步骤以及预期现象和结论.
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. |
|
步骤2:向A试管中滴加适量BaCl2溶液. | |
步骤3: |
|
(3)已知C中有0.1mol Cl2参加反应.若假设一成立,可推知C中反应的化学方程式为 .

(1)写出KIO3与KI在稀硫酸介质中发生反应的离子方程式
(2)为测定菜加碘盐中碘元素的含量,某学生甲设计了如下实验:
A、准确称取wg食盐,使其完全溶解在适量的蒸馏水中;
B、用稀硫酸酸化所得溶液,加入过量的Ⅺ溶液,使其充分反应;
C、以 为指示剂,运滴加入物质的量浓度为2.0×10﹣3mol/L的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为 , 则该加碘盐样品中碘元素的含量为 mg/Kg(用含w的代数式表示).(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)
(3)某学生乙又进行了下列实验:
A、准确称取1.0g纯净的NaCl,加3mL蒸馏水配成溶液,溶液为无色;
B、滴入5滴指示剂和1mL 0.1mol/L Kl溶液,充分振荡,溶液不变化;
C、继续滴加l滴1mol/L的硫酸溶液,充分振荡,溶液变蓝色
推测实验中产生蓝色现象的原因,用离子方程式表示 根据学生乙的实验结果,请对学生甲的实验结果进行分 (偏大、偏小、正确),其原因是
某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取Cl2 , 化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O,他们设计了如下实验用于制取Cl2并验证其某些性质.
2CaSO4+2Cl2↑+2H2O,他们设计了如下实验用于制取Cl2并验证其某些性质.

请回答:
(1)该实验中A部分的装置是 (填写装置的序号).

(2)若要证明B中Na2SO3溶液已被氧化,所需要的化学试剂为 ;
(3)实验进行了一段时间后,他们要探究C中FeSO4溶液被氧化的程度,设计了以下的方案,请填写其中的空白:
实验目的 | 操作与结论 |
①FeSO4溶液完全未被氧化 | 实验①取少许溶液于试管中,滴入数滴 溶液,若溶液 色(选填“不变色”或“变红色”),说明溶液完全未被氧化. |
②FeSO4部分被氧化 | ②实验②:取少许溶液于试管中,滴入数滴酸性KMnO4溶液,若溶液 色;再另取少许溶液于试管中,滴加几滴KSCN溶液,溶液变 色,说明溶液被部分氧化. |
③FeSO4完全被氧化 | ③重复实验②在待测②液中滴加数滴酸性KMnO4溶液后,溶液不褪色,另一实验现象与②同. |
(4)完成酸性KMnO4溶液滴入FeSO4溶液中的离子反应方程式:
Mn4-+ Fe2++ = Mn2++ + .
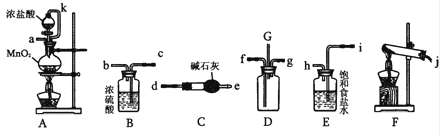
某校研究性学习小组设计实验,制取氯气以探究Cl2、Br2、I2的氧化性强弱(制取氯气的化学方程式为:MnO2+4HCl(浓) 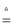 MnCl2+Cl2↑+2H2O),实验装置如图所示:
MnCl2+Cl2↑+2H2O),实验装置如图所示:

【实验探究】
(1)制取氯气的反应 (填“是”或“不是”)氧化还原反应.
(2)C装置中发生反应的化学方程式为 .
(3)D装置中溶液变 (填“黄色”或“蓝色”).
(4)E装置的作用是 .
(5)若要制取标准状况下4.48L的Cl2 , 需要MnO2的质量为 g.
(相对原子质量:H﹣1 O﹣16 Cl﹣35.5 Mn﹣55)
【实验讨论】
有些同学对上述实验装置持有不同看法:
甲同学认为:B装置是多余的.
乙同学认为:B装置是必须的.
你认为 (填“甲”或“乙”)同学的看法是正确的.
【结论分析】
实验现象表明,C装置中有Br2生成,D装置中有I2生成,说明Cl2的氧化性比Br2、I2强.但依据本实验能否判断Br2、I2的氧化性强弱,有些同学得出不同结论:
丙同学的结论是:可以判断Br2的氧化性比I2强.
丁同学的结论是:无法判断Br2的氧化性比I2强.
你认为 (填“丙”或“丁”)同学得出的结论是合理的.
某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应.其中D为纯净干燥的氯气与纯净干燥氨气反应的装置.
请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是 .
(2)装置E的作用是 ,橡胶管k的作用是 .
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是 .
(4)装置F中试管内发生反应的化学方程式 .
(5)接入D装置的两根导管左边较长、右边较短,目的是 .
(6)整套装置从左向右的连接顺序是(j)接 、 接(f)(g)接 、 接 、 接(a).

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.…
-
(1) A中产生黄绿色气体,其电子式是;A中发生的反应的化学反应方程式为.
-
(2) 验证氯气的氧化性强2KMnO4+16HCl═5Cl2↑+2MnCl2+2KCl+8H2O于碘的实验现象是.
-
(3) B中溶液发生反应的离子方程式是.
-
(4) 为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是.
-
(5) 过程Ⅲ实验的目的是.
-
(6) 实验结论:氯、溴、碘单质的氧化性逐渐,原因是:同主族元素从上到下,得电子能力逐渐.

已知:氯气和碱的反应为放热反应.温度较高时,氯气和石灰乳还能发生如下反应:6Cl2+6Ca(OH)2 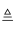 5CaCl2+Ca(ClO3)2+6H2O该兴趣小组设计了下列实验装置进行实验.
5CaCl2+Ca(ClO3)2+6H2O该兴趣小组设计了下列实验装置进行实验.
请回答下列问题:
-
(1) 实验室用甲装置制备氯气,其反应的化学方程式是.
-
(2) 乙装置的作用是;丁装置中发生反应的化学方程式.
-
(3) 小组成员发现,产物中Ca(ClO)2的质量明显小于理论值.可能原因有两个:
①部分氯气未与石灰乳反应而逸出;②.
-
(4) 已知浓盐酸和次氯酸钙也能反应产生氯气,写出该反应的化学方程式;若用储存很久的漂白粉与浓盐酸制氯气,则可能含有的杂质气体有H2O、.(填化学式)
-
(1) 炒菜时,加入酒和醋能使菜味香可口,原因是酒和醋反应生成了(填 “酯”或“盐”);
-
(2) 未成熟的苹果肉遇碘酒变(填“蓝”或“红”)色;
-
(3) 聚乙烯制品用途很广。请完成由乙烯制取聚乙烯的化学方程式:nCH2=CH2
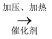 。
。
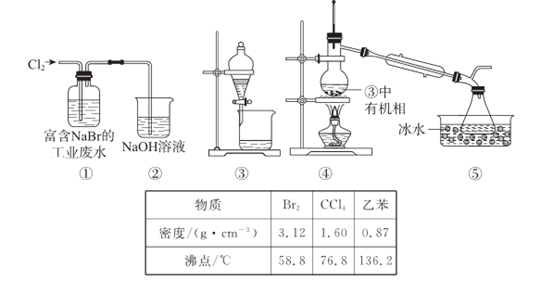
下列说法不正确的是( )
-
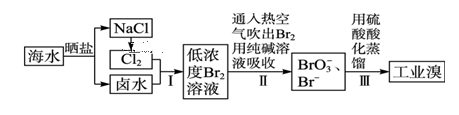
(1) 以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是。
-
(2) 步骤Ⅱ通入热空气吹出Br2,利用了溴的__________。A . 氧化性 B . 还原性 C . 挥发性 D . 腐蚀性
-
(3) 步骤Ⅱ中涉及的离子反应如下,请在下面横线上填入适当的化学计量数:Br2+CO32-= BrO3-+Br-+CO2↑
-
(4) 上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:。
-
(5) 实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是__________。A . 乙醇 B . 四氯化碳 C . 烧碱溶液 D . 苯
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向 3ml0.1mol/L 的 AgNO3 溶液中先加 入 4—5 滴 0.1mol/L 的 NaCl 溶液,再滴加 4—5 滴 0.1mol/L 的 NaI 溶液 | 先出现白色沉 淀后出现黄色 沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 将某气体通入品红溶液 | 品红溶液褪色 | 该气体是 SO2 |
| C | 用 pH 计测定等浓度的 Na2CO3 和NaClO 溶液的 pH | 后者 pH比前者 的小 | 非金属性:Cl>C |
| D | 将铜粉加入 1.0 mol/L Fe2(SO4)3 溶液中 | 溶液变蓝 | 氧化性Fe3+>Cu2+ |
| 难溶盐 | AgCl | AgBr | AgI | Ag2CrO4 | Ag2CO3 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 1.9×10-12 | 8.1×10-12 |
| 颜色 | 白色 | 淡黄色 | 黄色 | 砖红色 | 白色 |
可用作滴定Cl-指示剂的是( )

已知:3I2+6NaOH=5NaI+NaIO3+3H2O,下列有关说法错误的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向盛有BaCl2溶液的试管中通入SO2 , 振荡,出现白色沉淀 | 白色沉淀为BaSO4 |
| B | 向含碘废液X中加入FeCl3溶液,振荡,滴入淀粉溶液变蓝 | X中一定含有I- |
| C | 向盛有乙醇的试管中放入新切的钠块,平缓放出气体,钠块未熔化 | 钠与乙醇的反应为吸热反应 |
| D | 向试管中加入2mL10%CuSO4溶液,滴入4~5滴5%NaOH溶液,加入2mL10%麦芽糖溶液,加热,无红色沉淀 | 麦芽糖无还原性 |
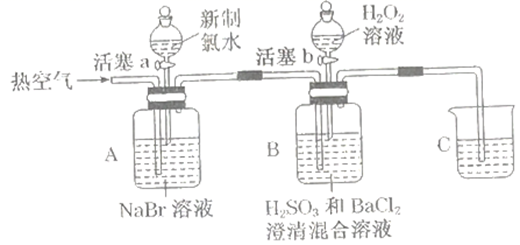
实验记录如下:
| 实验操作 | 实验现象 | |
| I | 打开活塞a,滴加少量新制氯水,关闭活塞a | A中溶液变为浅红棕色 |
| II | 吹入空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
| III | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | B中开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
-
(1) 新制氯水应保存在色的细口瓶中,盛装H2O2溶液的仪器名称是。
-
(2) 实验操作I时,A中反应的化学方程式为。
-
(3) 实验操作II吹入热空气的目的是吹出单质Br2 , 是体现了液溴的性质。
-
(4) 装置C中盛放的药品是溶液(填化学式)。C中反应的离子方程式为。
-
(5) 实验操作III,开始时颜色无明显变化,一段时间后,混合液逐渐变成红棕色。
①颜色无明显变化的可能原因是。
②逐渐变成红棕色,其对应的离子方程式为。
-
(6) 由上述实验得出的结论是。
 。回答下列问题:
。回答下列问题: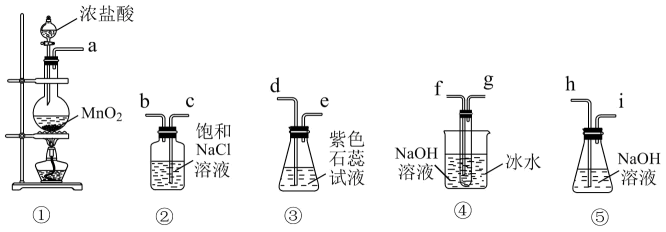
-
(1) 用下列仪器制取次氯酸钠和验证氯水的性质,则仪器的连接顺序为a→
 →
→ →
→ →
→ →d→e→h→I,。
→d→e→h→I,。
-
(2) 能否省去盛饱和NaCl溶液洗气瓶的装置②?(填“能”或“不能”),理由是。
-
(3) 装置③中的实验现象是。
-
(4) 装置④)中盛冰水的烧杯所起作用为。
-
(5) 装置④中的大试管内发生反应的离子方程式为。



