氯、溴、碘的性质实验 知识点题库
以下是有关SO2、Cl2的性质实验.
(1)某小组设计如图1所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.

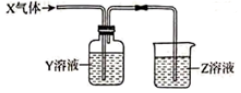
①若从左端分别通入SO2和Cl2 , 装置A中观察到的现象 (填“相同”或“不相同”);若装置D中装的V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 .
②SO2通入B中,溶液颜色褪去,则该反应的离子方程式为 .
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成.若向该试管中加入足量 (填字母),能产生白色沉淀.
A.氨水 B.稀盐酸 C.硝酸钾溶液 D.硫化钠溶液
(3)若由元素S和O组成价酸根离子X,X中S和O的质量比为2:3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式: .
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图2,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触,.通入SO2的电极为 极,其电极反应式为 ;电池的总反应式为 .

-
(1) 装置A中还应安装的玻璃仪器是,装置B用冰水浴的原因是.
-
(2) 装置A中产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:.
-
(3) ①实验过程中,装置C中少量的ClO2与NaOH溶液反应产生两种钠盐,且物质的量之比为1:1,其中一种为NaClO2 , 写出装置C中生成这两种钠盐的离子方程式:.
②饱和溶液在温度低于38℃时析出晶体NaClO2.3H2O,在温度高于38℃时析出晶体NaClO2 . 请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
a.;b.;c.洗涤;d.干燥.
-
(4) 还可采用盐酸或双氧水还原氯酸钠制备ClO2 . 用H2O2作还原剂制备ClO2更受欢迎,其主要原因是.
| 选项 | 实验 | 现象 | 结论 |
| A | 将氯气通入品红溶液 | 溶液红色褪去 | 氯气具有漂白性 |
| B | 将铜粉加入1.0mol•L﹣1 的Fe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属Fe比Cu活泼 |
| C | 用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点比较低 |
| D | 向盛有少量浓硝酸、稀硝酸的两支试管中分别加入一片大小相同的铜片 | 浓硝酸中铜片很快开始溶解,并放出红棕色气体;稀硝酸中过一会铜片表面才出现无色气体,气体遇空气变红棕色 | 浓硝酸氧化性强于稀硝酸 |
| 选项 | ① | ② | ③ | 实验目的 | |
| A | 稀硫酸 | Na2S | AgCl的浊液 | 验证Ag2S比AgCl难溶 | |
| B | 浓硝酸 | Cu片 | NaOH溶液 | 探究浓硝酸具有氧化性 | |
| C | 硫酸 | Na2SO3 | 酸性KMnO4溶液 | 探究SO2具有还原性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 验证酸性:硝酸>碳酸>硅酸 |
|
选项 |
X |
Y |
Z |
结论 |
|
A |
Cl2 |
品红溶液 |
NaOH溶液 |
Cl2具有漂白性 |
|
B |
C2H4 |
溴水 |
酸性KMnO4溶液 |
Y溶液反应为取代反应 |
|
C |
NH3 |
AlCl3溶液 |
硫酸溶液 |
NH3•H2O具有弱碱性 |
|
D |
CO2 |
Na2SiO3溶液 |
NaOH溶液 |
酸性:碳酸>硅酸 |
| 选项 | 操作 | 现象 | 解释与结论 |
| A | 向NaI溶液中滴入少量新制氯水和苯,振荡、静置 | 上层溶液呈紫红色 | I-还原性强于Cl- |
| B | 无水乙醇与浓硫酸共热至170℃,将产生的气体通入溴水 | 溴水褪色 | 乙烯和溴水发生加成反应 |
| C | 向物质的量浓度、体积均相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者红色更深 | 水解程度:CO |
| D | 室温下,向浓度均为0.01mol·L-1的KCl和KI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
-
(1) 在H2O2溶液中加入少量MnO2
-
(2) 将密封有NO2的玻璃球浸泡在冰水中(已知
 )
)
-
(3) 将向含有KI和H2SO4的混合溶液中加入淀粉溶液,放置一段时间
| 实验操作 | 现象 | 结论 | |
| A | 向溶液中先加入氯水,再加入淀粉溶液 | 溶液变黄色 | 溶液中含有I- |
| B | 取一根洁净的铂丝,放在酒精灯火焰上灼烧至无色,然后蘸取少量试液,置于火焰上灼烧,透过蓝色钴玻璃观察 | 火焰呈紫色 | 溶液中含有K+ |
| C | 向某溶液中先加入CaCl2溶液,再加入足量稀盐酸 | 产生白色沉淀,后溶解 | 溶液中含有 |
| D | 向溶液中先加入BaCl2溶液,再加入足量稀硝酸 | 产生白色沉淀,后沉淀不溶解 | 溶液中含有 |
 的消毒液可用于个人与环境消毒,但含
的消毒液可用于个人与环境消毒,但含  的消毒液与医用酒精不可混用,混用会产生有毒气体
的消毒液与医用酒精不可混用,混用会产生有毒气体  ,发生的主要反应为:①
,发生的主要反应为:①  ,②……(后续反应略)。
,②……(后续反应略)。 下列关于氯气和新制氯水的说法正确的是( )
 中燃烧生成
中燃烧生成  B . 向加有淀粉的
B . 向加有淀粉的  溶液中通入少量
溶液中通入少量  后溶液变蓝,说明
后溶液变蓝,说明  的氧化性强于
的氧化性强于  C .
C .  溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中含有
溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中含有  D . 用强光照射新制氯水一段时间后,溶液
D . 用强光照射新制氯水一段时间后,溶液  增大
增大
 为原料制取
为原料制取 时加入
时加入 , 可以降低能耗
B . 工业生产异丙苯用无水
, 可以降低能耗
B . 工业生产异丙苯用无水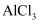 作催化剂,相较分子筛固体酸对环境污染更小
C . 工业提取碘的过程中加入
作催化剂,相较分子筛固体酸对环境污染更小
C . 工业提取碘的过程中加入 溶液目的是中和过量的酸
D . 煤的气化和液化目的是减少
溶液目的是中和过量的酸
D . 煤的气化和液化目的是减少 的排放
的排放
选项 | 实验操作 | 类比 |
A | 电解CuSO4溶液可以得到Cu单质 | 电解Al2(SO4)3溶液可以制备Al单质 |
B | Fe在常温下遇到浓硫酸钝化 | Mg在常温下遇到浓硫酸也会纯化 |
C | CCl4可以萃取碘水中的I2 | CCl4可以萃取溴水中的Br2 |
D | 往NaHCO3溶液中滴入酚酞溶液,溶液变红 | NaHSO4溶液也能使酚酞溶液变红 |
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
-
(1) 第三周期元素中非金属性最强的元素的原子结构示意图是。
-
(2) ⑥的最高价氧化物对应的水化物分别与⑤、⑨的最高价氧化物对应的水化物反应的离子方程式是、。
-
(3) 下列可以判断⑤和⑥金属性强弱的是(填序号)。
a.单质的熔点:⑤<⑥ b.化合价:⑤<⑥
c.单质与水反应的剧烈程度:⑤>⑥ d.最高价氧化物对应水化物的碱性:⑤>⑥
-
(4) ②③⑦的最高价氧化物均是(填“离子化合物”“共价化合物”)。
-
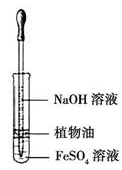
(5) 为验证第ⅦA族部分元素非金属性的递变规律,设计如图装置进行实验,请回答:

①仪器A的名称是,A中发生反应的离子方程式是。
②验证溴与碘的非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,振荡、静置,可观察到。
③第ⅦA族元素非金属性随元素核电荷数的增加而逐渐减弱的原因:同主族元素从上到下,。
实验① | 实验② | 实验③ | 实验④ |
|
|
|
|
溶液变为浅黄绿色 | 溶液变为黄色 | 溶液变为棕黄色 | 溶液变为蓝色 |
下列说法错误的是( )

 B . ②中根据试管口出现白雾说明有
B . ②中根据试管口出现白雾说明有 产生,证明酸性:
产生,证明酸性: C . ③中浓
C . ③中浓 被还原成
被还原成 D . 收集①中产生的气体溶于水形成有色溶液,将③中产生的气体通如其中,证明③中产生的气体具有漂白性
D . 收集①中产生的气体溶于水形成有色溶液,将③中产生的气体通如其中,证明③中产生的气体具有漂白性

 >HCO..
>HCO..








