二氧化硫的漂白作用 知识点题库
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
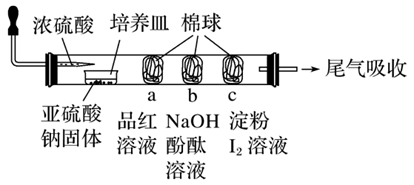
(1)为了探究SO2能否使品红褪色,该同学选择了正确的药品后,设计了如图1所示实验装置,请指出实验装置图设计中的不合理之处.

① ;② .
(2)该同学选择了正确装置后,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.为此,你认为使品红的水溶液褪色的微粒可能是 .
(3)该同学进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,他得出结论:使品红褪色的微粒肯定是HSO3﹣或SO32﹣ . 你认为他的结论是否正确 ,其理由是 .
(4)再用如图2装置探究SO2的某些化学性质.
①装置乙的作用是 .
②若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 .
a.氧化性 b.还原性 c.漂白性 d.不稳定性
③若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
□Ca2﹣+□ClO﹣+□SO2+□H2O= ↓+□Cl﹣+□SO42﹣+□______.
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.

(1)实验室用装置A制备SO2 . 某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是 .
(2)实验室用装置E制备Cl2 , 其反应的离子方程式为 ;若有6mol的HCl参加反应,则转移的电子总数为 .
(3)停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B: , D: .
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用化学方程式表示) .

-
(1) 写出木炭与浓硫酸反应的化学方程式。
-
(2) 分液漏斗使用前需检漏,方法是。
-
(3) 有同学对C装置能否除尽还原性气体有疑义,要确认其是否除尽,你认为对上述装置应做如何进?。
| 选项 | 表述Ⅰ | 表述Ⅱ |
| A | 常温下铝在浓硫酸中发生钝化 | 可用铝槽车密封运送浓硫酸 |
| B | SO2有漂白性 | SO2通入品红溶液中,溶液褪色 |
| C | 热稳定性:Na2CO3>NaHCO3 | 同浓度溶液碱性:Na2CO3>NaHCO3 |
| D | 非金属性:F>Cl | 氢化物的稳定性:HF>HCl |
-
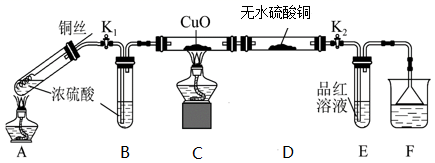
(1) 实验室用废铜屑制备SO2的化学方程式为。
-
(2) 将SO2通入NaHS溶液,溶液中有淡黄色沉淀,说明SO2具有性。
-
(3) 将SO2通过品红溶液,溶液红色逐渐褪去,将褪色后的溶液微热,又显浅红色,这现象可解释为。
-
(4) 将SO2通入橙黄色酸性K2Cr2O7溶液,溶液逐渐变为浅绿色,该反应中氧化剂与还原剂的物质的量之比为。(Cr2O72-被还原为Cr3+)
-
(5) 常温下,改变0.1mol•L-1H2SO3溶液(SO2水溶液)的pH,溶液中的H2SO3、HSO3-、SO32-的物质的量分数δ(X)[δ(X)=
 ]随pH的变化如图所示:
]随pH的变化如图所示: 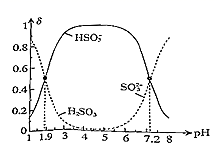
H2SO3的lgKa1=;反应HSO3-+OH-
 SO32-+H2O的lgK=;用0.100mol•L-1NaOH溶液滴入0.100mol•L-1H2SO3溶液(甲基橙作指示剂)中,溶液由红色变为橙色时,发生的主要反应的离子方程式为。
SO32-+H2O的lgK=;用0.100mol•L-1NaOH溶液滴入0.100mol•L-1H2SO3溶液(甲基橙作指示剂)中,溶液由红色变为橙色时,发生的主要反应的离子方程式为。
| 选项 | 溶液 | 预测的现象 | 分析 |
| A | FeCl3溶液 | 溶液由棕黄色变浅绿色 | SO2有还原性 |
| B | 品红溶液 | 溶液红色褪去 | SO2有漂白性 |
| C | 酸性KMnO4溶液 | 溶液紫色褪去 | SO2有氧化性 |
| D | Na2SiO3溶液 | 产生白色胶状沉淀 | SO2水溶液的酸性比H2SiO3强 |

|
选项 |
实验操作 |
实验现象 |
结论 |
|
A |
向某盐溶液中先加入氯水,再滴加KSCN溶液 |
溶液变红色 |
可能含有 |
|
B |
取少量某无色溶液,先滴加氯水,再加入少量 |
溶液分层,下层呈紫红色 |
原无色溶液中一定有 |
|
C |
|
溶液红色褪去 |
|
|
D |
少量Zn粉加入1.0 |
溶液颜色变浅 |
金属Zn比Fe活泼 |

 ,振荡、静置
,振荡、静置
 缓慢通入滴有酚酞的NaOH溶液中
缓慢通入滴有酚酞的NaOH溶液中
 溶液中
溶液中


