二氧化硫的漂白作用 知识点题库
资料卡 NO:2006﹣KI﹣001 主题:二氧化硫的还原性 ①课本上:向二氧化硫水溶液中滴加BaCl2溶液,再滴加0.5mL3%的过氧化氢溶液,振荡片刻后滴加稀盐酸,有白色沉淀生成 ②《无机化学》下册,P658:亚硫酸是较强的还原剂,可以将Cl2、I2、MnO4﹣还原为Cl﹣、I﹣、Mn2+ , 如: H2SO3+I2+H2O═H2SO4+2HI |
根据上述资料,请你参与以下探究:
-
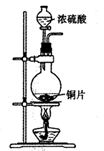
(1) 写出铜与浓硫酸反应的化学方程式;
-
(2) 把足量SO2通入适量的碘水中,可能观察到的现象是;
-
(3) 证明SO2被氧化为SO42﹣所使用的试剂是;
-
(4) 如果该探究小组想利用上述原理除去CO2中的SO2 , 并检验是否除尽,下列方案可行的是 (填字母)A . 将混合气体通过碘水,再通过品红溶液 B . 将混合气体通过氯化钡和过氧化氢的混合溶液,再通过碘水溶液 C . 将混合气体通过NaOH溶液,再通过品红溶液 D . 将混合气体通过浓硫酸溶液,再通过品红溶液
-
(5) 若该探究小组就上述实验提出,把含+4价硫元素化合物转化为含+6价硫元素化合物,下列试剂可以实现上述转化的是 (填字母)A . 氧气 B . MnO4﹣ C . 氯气 D . 浓硫酸.

请回答下列问题:
-
(1) 装置A中盛放亚硫酸钠的仪器名称是。
-
(2) 实验过程中,装置B中产生的现象是,这个现象说明SO2具有的性质是。
-
(3) 装置C中Na2S溶液在空气中不易保存,时间长了会变浑浊,原因是(用离子方程式表示)。
-
(4) 装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象。
-
(5) 如果把分液漏斗中的浓硫酸换作浓HNO3 , 对此实验是否有影响(填“是”或“否”),请说明你的理由。
-
(6) 工业上用黄铜矿(CuFeS2)冶炼铜,副产品中也有SO2 , 冶炼铜的反应为8CuFeS2 + 21O2
 8Cu + 4FeO + 2Fe2O3 + 16SO2 , 若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号)。当生成0.8mol铜时,此反应转移的电子数目是。
8Cu + 4FeO + 2Fe2O3 + 16SO2 , 若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号)。当生成0.8mol铜时,此反应转移的电子数目是。

 B . 验证漂白性
B . 验证漂白性 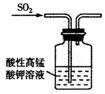 C . 验证氧化性
C . 验证氧化性 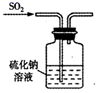 D . 尾气处理
D . 尾气处理 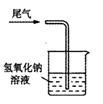
| 选项 | 实验操作与现象 | 实验结论 |
| A | 向某溶液中加入AgNO3溶液,有白色沉淀生成 | 该溶液中一定含有Cl- |
| B | 向某溶液中加入BaCl2溶液,有白色沉淀生成,再滴加过量稀盐酸,沉淀不溶解 | 该溶液中一定含有 |
| C | 将SO2通入少量酸性高锰酸钾溶液,高锰酸钾溶液褪色 | SO2具有漂白性 |
| D | 将NH3通过灼热的氧化铜固体,固体由黑色变为红色 | NH3具有还原性 |
①品红溶液:
②酸性KMnO4溶液;
③滴有酚酞的NaOH溶液:
④溴水;
⑤淀粉碘溶液。
| 序号 | 试剂及操作 | 部分现象 | 结论 |
| A | | 滴入稀盐酸后铜片继续溶解,产生无色气体,在试管口处变为淡棕色 | 盐酸具有氧化性 |
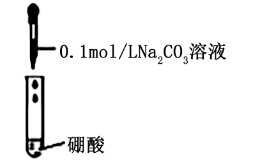
| B | | 有气体生成 | 酸性: 硼酸强于碳酸 |
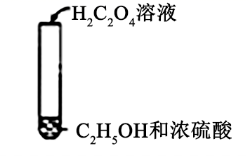
| C | | 加热后产生有香味物质 | H2C2O4可发生酯化反应 |
| D | | 试管内红色褪去 | SO2具有漂白性 |

| ①中试剂 | ①中现象 | 解释 | |
| A | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
| C | 溴水 | 橙色褪去 | SO2具有还原性 |
| D | 酸性Ba(NO3)2溶液 | 生成白色沉淀 | SO |
 的性质。实验时向
的性质。实验时向  固体上滴几滴浓硫酸,立即用另一培养皿扣在上面。表中对实验现象的描述或解释不正确的是( )
固体上滴几滴浓硫酸,立即用另一培养皿扣在上面。表中对实验现象的描述或解释不正确的是( ) 
| 选项 | 实验现象 | 解释 |
| A | | |
| B | | |
| C | | |
| D | 含有酚酞的 | |
| 选项 | 实验操作和现象 | 实验结论 |
| A | 将 | |
| B | 向3mL | |
| C | 将打磨干净的铝箔在酒精灯火焰上加热熔化,有液体滴落 | 铝箔表面的氧化铝的熔点高于铝的熔点 |
| D | 用洁净的铂丝蘸取某溶液后,在酒精灯火焰上灼烧,火焰呈黄色 | 该溶液中一定含有钠元素 |
 干扰
D . 向溶液中加入新制氯水,再滴加KSCN溶液,若溶液变红,则证明原溶液中一定含有Fe2+
干扰
D . 向溶液中加入新制氯水,再滴加KSCN溶液,若溶液变红,则证明原溶液中一定含有Fe2+
 的相关性质,某同学用下图所示的装置做了实验。下列有关实验的描述正确的是( )
的相关性质,某同学用下图所示的装置做了实验。下列有关实验的描述正确的是( )
 的氧化性
C .
的氧化性
C .  溶液浸湿的试纸变色,淀粉碘溶液褪色体现了
溶液浸湿的试纸变色,淀粉碘溶液褪色体现了 的漂白性
D . 气球的作用是收集多余的尾气,防止污染空气
的漂白性
D . 气球的作用是收集多余的尾气,防止污染空气
选项 | 实验 | 现象 | 结论 |
A | 向 | 产生白色沉淀,且有无色气体生成 | 溶液中 |
B | 检验某无色溶液中是否含有 | 溶液变黄色且试管上部产生红棕色气体 | 该溶液中含有 |
C | 将铜粉放入稀硫酸溶液中并不断通入 | 铜粉快速溶解,溶液变为蓝色 | 形成 |
D | 向某钾盐中滴加浓盐酸,产生的气体再通入品红溶液 | 品红溶液褪色 | 该钾盐为 |
 后,两支试管中溶液的颜色分别是( )
后,两支试管中溶液的颜色分别是( )
①石灰水②氯水③酸性KMnO4溶液④BaCl2溶液⑤品红溶液




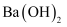 溶液变浑浊
溶液变浑浊 沉淀
沉淀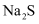 溶液变浑浊
溶液变浑浊 单质
单质 溶液褐色
溶液褐色 溶液褪色
溶液褪色 通入酸性
通入酸性  溶液中,紫色褪去
溶液中,紫色褪去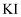 溶液中滴加1mL淀粉溶液,再向其中滴加几滴溴水振荡,溶液显蓝色
溶液中滴加1mL淀粉溶液,再向其中滴加几滴溴水振荡,溶液显蓝色 的氧化性比
的氧化性比 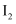 的强,同时说明
的强,同时说明  的还原性比
的还原性比  的强
的强 溶液中滴入
溶液中滴入 溶液
溶液 部分电离出
部分电离出 和
和 ,
,  与
与 沉淀,促进了
沉淀,促进了 的电离,使
的电离,使
 , 取少量该溶液于试管中,加稀盐酸酸化,再加入
, 取少量该溶液于试管中,加稀盐酸酸化,再加入 溶液
溶液 , 再在溶液中滴加少量
, 再在溶液中滴加少量 溶液
溶液 原电池,加快反应速率
原电池,加快反应速率 或
或 或者二者混合物
或者二者混合物


