二氧化硫的漂白作用 知识点题库
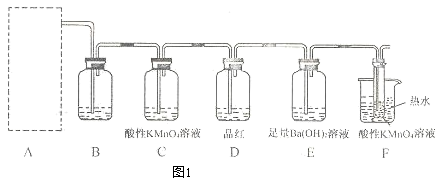
某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:

(1)实验室常用装置E制备Cl2 , 指出该反应中浓盐酸所表现出的性质 ,
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:
B D
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:

通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,试根据该实验装置和两名同学的实验结果
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸的两个目的 、 .
②试分析甲同学实验过程中,品红溶液不褪色的原因是: 、 ,并用离子方程式表示
③你认为乙同学是怎样做到让品红溶液变得越来越浅的? .
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
(1)实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,现有下列三种硫酸溶液,应选用 (填字母),理由是 ;
A.98%浓硫酸B.70%硫酸C.10%稀硫酸
(2)为了探究SO2能否使品红褪色,该同学选择了正确的药品后设计了如图所示实验装置,请指出实验装置设计中的不合理之处.
① ;② .
(3)该同学选择了正确装置后,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.为此,你认为使品红的水溶液褪色的微粒可能是 .
(4)该同学进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,他得出的结论:使品红褪色的微粒肯定是HSO3﹣或SO32﹣ . 你认为他的结论是否正确 , 其理由是 .

某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证甲、乙两同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置已略去).

请回答:
(1)上述实验中生成二氧化硫气体的化学方程式为 .
(2)乙同学认为还可能产生氢气的理由是 .
(3)A中加入的试剂可能是 ,作用是 ;B中加入的试剂可能是 ,其作用是 ;E中加入的试剂可能是 ,作用是 .
(4)可以证明气体X中含有氢气的实验现象:
C中: ,
D中: .
如果去掉装置B,还能否根据D中的现象判断气体X中含有氢气? (填“能”或“不能”),原因是 .
(5)工业上常常将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4 , 该过程的化学方程式为 .


-
(1) 检查E装置气密性的方法是
-
(2) 实验室用装置E制备Cl2气体,写出E中发生反应的离子方程式:.
-
(3) 反应开始后一段时间后,观察到B、D两个试管中的品红溶液出现的现象是::(填写序号)
①都褪色 ②都不褪色 ③B褪色,D不褪色 ④B不褪色,D褪色
停止通气后,再给B、D两个试管加热,两个试管中的现象分别为B:,D:.
-
(4) 第二个实验小组的同学认为SO2和Cl2水都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果并不像想象的那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如下图实验装置:
①实验开始后,乙装置中出现的现象:
②用离子方程式表示乙中产生该现象的原因:
回答下列问题:
-
(1) 欲验证SO2的漂白作用,应将SO2气体通入中(填物质编号),观察到的现象是;
-
(2) 欲验证SO2的还原性,应将SO2气体通入中(填物质编号),观察到的现象是;
-
(3) 为说明SO2的氧化性,通常利用的反应是;
-
(4) 为防止多余的SO2气体污染环境,应将尾气通入中(填物质编号),反应离子方程式为;
-
(5) 有一实验小组发现,SO2产生缓慢(不考虑SO2)在溶液中的溶解,实验中也不存在漏气、反应温度等装置和操作上的问题),请你推测可能的原因(至少填写一种):①,②.
-
(1) 观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是(填序号);
-
(2) 为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
试回答下列问题:
①图1的A中最好选用下列装置(填编号);
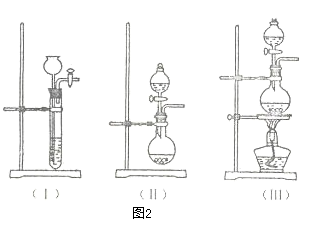
②图1的 B装置所装试剂是;D装置中试剂的作用是;E装置中发生的现象是;
③图1的A装置中使蔗糖先变黑的化学反应方程式为,后体积膨胀的化学方程式为:;
④某学生按图进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因,其反应的离子方程式是。
| 现象或操作 | 解释 | |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2 , 蓝色褪去 | SO2具有漂白性 |
| B | 配制FeCl3溶液时,先将FeCl3溶于适量浓盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉 | 抑制Fe3+水解,并防止Fe3+变质 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 不能说明该溶液中一定含有SO42- |
| D | 向含有Cu(OH)2和AgNO3的溶液中滴加Na2S溶液,生成黑色沉淀 | Ksp(Ag2S)<Ksp(CuS) |
 夹持装置未画出、
夹持装置未画出、  固体易升华
固体易升华  的说法正确的是( )
的说法正确的是( ) 
 中封管内固体消失
B . 加热时,
中封管内固体消失
B . 加热时,  中溶液变红,冷却后又变为无色
C . 加热时,
中溶液变红,冷却后又变为无色
C . 加热时, 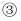 中溶液变红,冷却后红色褪去,体现
中溶液变红,冷却后红色褪去,体现  的漂白性
D . 加热又冷却的过程中,
的漂白性
D . 加热又冷却的过程中, 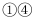 属于物理变化,
属于物理变化, 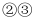 属于化学变化
属于化学变化
| 选项 | 操作和现象 | 结论 |
| A | 向某溶液中加入稀盐酸,有刺激性气味的气体产生,将气体通入澄清石灰水,石灰水变浑浊 | 该溶液中一定含有SO |
| B | 二氧化硫通入酸性高锰酸钾溶液,紫红色褪去 | SO2有漂白性 |
| C | 将铝片分别放入足量浓硝酸,稀硝酸溶液中,浓硝酸无明显变化,稀硝酸有大量气泡产生 | 氧化性:稀硝酸>浓硝酸 |
| D | 蔗糖固体加入浓硫酸,出现“黑面包现象” | 浓硫酸具有脱水性和强氧化性 |
①滴有酚酞的氨水 ②滴有酚酞的氢氧化钠溶液 ③溶有SO2的品红溶液 ④滴有酚酞的饱和氢氧化钙溶液
| A | B | C | D |
| | | | |
| 制取 | 验证 | 制取少量 | 检验该条件下铁发生了吸氧腐蚀 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向H2O2溶液中滴加少量KMnO4溶液,紫红色褪去 | H2O2具有氧化性 |
| B | 将二氧化硫气体通入品红溶液,品红溶液褪色 | 二氧化硫具有漂白性 |
| C | 向蔗糖中滴入浓硫酸,固体变黑膨胀 | 浓硫酸具有吸水性 |
| D | AgCl悬浊液中滴入稀KI溶液,有黄色沉淀出现 | KSPAgI > KSPAgCl |
 2Fe+3CO
C . 晶体硅是一种半导体材料,应用于电子工业
D . 二氧化硫可用于漂白纸浆及草帽等编织物
2Fe+3CO
C . 晶体硅是一种半导体材料,应用于电子工业
D . 二氧化硫可用于漂白纸浆及草帽等编织物
 浓硫酸,在烧杯中加入饱和的氢氧化钠溶液,将螺旋状的铜丝连接在2号注射器活塞的橡胶上,1号注射器配有较长的耐腐蚀的针头。
浓硫酸,在烧杯中加入饱和的氢氧化钠溶液,将螺旋状的铜丝连接在2号注射器活塞的橡胶上,1号注射器配有较长的耐腐蚀的针头。
请回答:
-
(1) 试剂b为
-
(2) 推动2号注射器活塞,将铜丝浸没在浓硫酸中,加热试管a,使反应开始进行,实验任务完成后,使反应停止的操作:
-
(3) 利用1号注射器证明该实验中有
 生成的具体操作和现象:
生成的具体操作和现象:
-
(4) 实验结束后,如何检验烧杯中是否有硫酸根离子?
①氧气 ②二氧化碳 ③氯化氢 ④氯气 ⑤一氧化氮 ⑥氨气 ⑦二氧化硫
回答下列问题:
-
(1) 上述物质中溶于水能导电的非电解质是(填序号)。
-
(2) 上述两种无色气体相遇易产生白烟的是(填序号)。
-
(3) 写出铜和稀
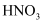 反应产生一氧化氮的化学方程式。用双线桥表示下列反应电子转移的方向和数目:
反应产生一氧化氮的化学方程式。用双线桥表示下列反应电子转移的方向和数目:

-
(4) 上述气体中(填序号)能使品红溶液褪色,在通常状况下,将这两种气体等体积同时通入紫色石蕊试液中,观察到的现象是,其原因是(用离子方程式表示)。
-
(5) 二氧化碳(填“能”或“不能”)形成酸雨,理由是。










