二氧化硫的漂白作用 知识点题库
已知二氧化硫气体可使澄清石灰水变浑浊,也能使酸性高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4
用图装置(还有一部分装置没画出)来验证某混合气体中同时含有SO2和CO2
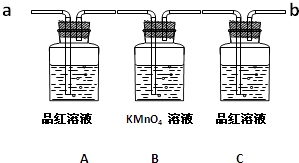
①实验时,该混合气体应从端通入; 从端连接盛有澄清石灰水的实验装置(用“a”或“b”填空).
②预期能观察到A瓶溶液中的现象为.
③C瓶溶液的作用是.
④证明该混合气体中含有CO2的实验现象是.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
-
(1) 实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,现有下列三种硫酸溶液,应选用(填字母),理由是;
A.98%浓硫酸B.70%硫酸C.10%稀硫酸
-
(2) 为了探究SO2能否使品红褪色,该同学选择了正确的药品后设计了如图所示实验装置,请指出实验装置设计中的不合理之处.
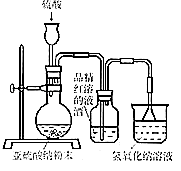
① ;②.
-
(3) 该同学选择了正确装置后,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.为此,你认为使品红的水溶液褪色的微粒可能是.
-
(4) 该同学进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,他得出的结论:使品红褪色的微粒肯定是HSO3﹣或SO32﹣ . 你认为他的结论是否正确,其理由是.
小明同学非常喜欢实验探究课,为了探究SO2的相关性质做了下列实验,请根据下列情况回答相关问题.
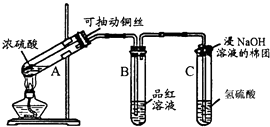
探究一:铜与浓硫酸反应产物的鉴定
-
(1) 试管B中的实验现象是.试管C中溶液变浑浊,则证明SO2具有性.
-
(2) 试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是,如果浸NaHCO3溶液,则发生反应的化学方程式是.
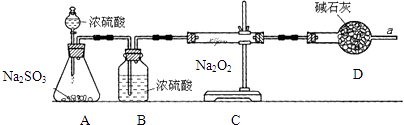
探究二:已知CO2和SO2的化学性质具有相似性和差异性.某同学为了确认干燥的SO2和Na2O2反应中是否有氧气生成吗,拟使用下列装置进行实验.
-
(3) D装置的作用是.
-
(4) 为确认SO2和Na2O2反应的产物,该同学设计了以下实验操作,你认为应该进行的操作(按先后顺序排列)是 (填序号).A . 用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧. B . 将C装置中反应后的固体物质溶于适量水配成溶液. C . 在配成的溶液中加入用硝酸(氧化性酸)酸化的硝酸钡溶液,观察是否有沉淀生成. D . 在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成.
下列有关物质的性质与用途具有对应关系的是( )
A . NH4HCO3受热易分解,可用作化肥
B . 稀硫酸具有酸性,可用于除去铁锈
C . SO2具有氧化性,可用于纸浆漂白
D . Al2O3具有两性,可用于电解冶炼铝
下列能使品红溶液褪色,且褪色原理基本相同的是( )
①活性炭 ②氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠⑥双氧水
A . ①②④
B . ②③⑤
C . ②④⑤⑥
D . ①②③④⑤⑥
化学与生活密切相关,下列说法正确的是( )
A . SO2有漂白性,但用二氧化硫漂白过的草帽辫日久又变成黄色
B . 高纯度的SiO2是制作电脑芯片的基础材料
C . 酒精可以使蛋白质变性,酒精纯度越高杀菌效果越好
D . 用食用油油炸可烹制美味的食品,食用油可反复加热使用
下列有关物质的性质与用途具有对应关系的是( )
A . NaClO能使蛋白质变性,可用作环境消杀剂
B . SO2具有刺激性气味,可用作纸浆的漂白剂
C . FeCl3易溶于水,可用作H2O2分解的催化剂
D . Al(OH)3具有两性,可用作塑料制品的阻燃剂
下列能用同一原理解释的是( )
A . 福尔马林、葡萄糖与新制Cu(OH)2共热都有红色沉淀生成
B . NH4Cl晶体、固体碘受热都会汽化
C . SO2、Cl2都能使品红溶液褪色
D . 苯、乙烯都能使溴水褪色
下列变化中可以说明SO2具有漂白性的是( )
A . SO2通入高锰酸钾酸性溶液中紫色褪去
B . SO2通入品红溶液中红色褪去
C . SO2通入溴水溶液中红棕色褪去
D . SO2通入氢氧化钠与酚酞的混合溶液中红色褪去
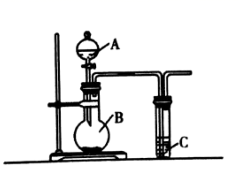
利用如图所示实验装置可完成中学化学中的一些实验。请回答下列问题:
-
(1) 仪器A的名称为。
-
(2) 若要证明非金属性:Cl>S,则可在A中加浓盐酸,B中加KMnO4(已知:KMnO4与浓盐酸常温下反应可生成氯气),C中加入Na2S溶液,观察到C中产生淡黄色浑浊的现象,即可证明,C中发生反应的离子方程式为,若从环境保护的角度考虑,此装置还缺少尾气处理装置,可用溶液吸收尾气。
-
(3) 现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4>H2CO3>H2SiO3 , 回答下列问题:
①A中试剂为,B中试剂为。
②要得出酸性H2SO4>H2CO3>H2SiO3的结论,则C中应观察到的现象为。
-
(4) 利用如图装置证明SO2气体具有漂白性。已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。在装置A中加入70%的硫酸溶液,B中加入Na2SO3粉末,C中加入品红溶液。打开分液漏斗活塞,一段时间后C中观察到的现象是,待反应完全后,将试管C加热一段时间发生的现象是,即可证明SO2气体具有漂白性。
“封管实验”具有简易、方便、节约、绿色等优点,关于如图所示三个“封管实验”(夹持装置未画出)的说法正确的是( )
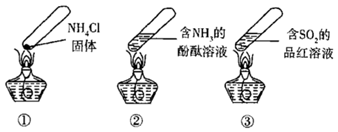
A . 加热时,①中上部汇集了  固体
B . 加热时,②中溶液变红,冷却后又变为无色
C . 加热时,③中溶液红色褪去,冷却后溶液变红,体现
固体
B . 加热时,②中溶液变红,冷却后又变为无色
C . 加热时,③中溶液红色褪去,冷却后溶液变红,体现  的漂白性
D . 三个“封管实验”中所发生的化学反应都是可逆反应
的漂白性
D . 三个“封管实验”中所发生的化学反应都是可逆反应
 固体
B . 加热时,②中溶液变红,冷却后又变为无色
C . 加热时,③中溶液红色褪去,冷却后溶液变红,体现
固体
B . 加热时,②中溶液变红,冷却后又变为无色
C . 加热时,③中溶液红色褪去,冷却后溶液变红,体现  的漂白性
D . 三个“封管实验”中所发生的化学反应都是可逆反应
的漂白性
D . 三个“封管实验”中所发生的化学反应都是可逆反应
下列说法错误的是( )
A .  均可通过化合反应生成
B . 用惰性电极分别电解
均可通过化合反应生成
B . 用惰性电极分别电解  溶液,均为电解水
C . 将
溶液,均为电解水
C . 将  气体分别通入紫色石蕊试液中,均出现溶液先变红后褪色
D . 将铁片和铝片置于冷的浓硝酸中均发生钝化
气体分别通入紫色石蕊试液中,均出现溶液先变红后褪色
D . 将铁片和铝片置于冷的浓硝酸中均发生钝化
 均可通过化合反应生成
B . 用惰性电极分别电解
均可通过化合反应生成
B . 用惰性电极分别电解  溶液,均为电解水
C . 将
溶液,均为电解水
C . 将  气体分别通入紫色石蕊试液中,均出现溶液先变红后褪色
D . 将铁片和铝片置于冷的浓硝酸中均发生钝化
气体分别通入紫色石蕊试液中,均出现溶液先变红后褪色
D . 将铁片和铝片置于冷的浓硝酸中均发生钝化
推理是一种重要的能力。打开分液漏斗活塞,进行如图所示的探究实验,对实验现象的预测及分析错误的是( )
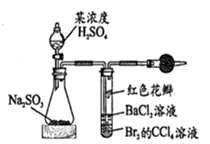
A . 试管内CCl4层溶液褪色,说明Br2具有氧化性
B . 试管中的红色花瓣褪色,说明SO2具有漂白性
C . 一段时间后试管内有白色沉淀,说明有SO  生成
D . 试管中产生大量气泡,说明Na2SO3被氧化产生SO3
生成
D . 试管中产生大量气泡,说明Na2SO3被氧化产生SO3
 生成
D . 试管中产生大量气泡,说明Na2SO3被氧化产生SO3
生成
D . 试管中产生大量气泡,说明Na2SO3被氧化产生SO3
某同学用下列装置探究  性质实验(夹持装置已省略),下列说法错误的是( )
性质实验(夹持装置已省略),下列说法错误的是( )
 性质实验(夹持装置已省略),下列说法错误的是( )
性质实验(夹持装置已省略),下列说法错误的是( ) 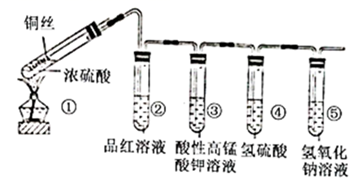
A . 实验结束后,直接向①中试管加水,观察颜色可确定  的生成
B . 试管②中品红溶液逐渐褪色,体现了
的生成
B . 试管②中品红溶液逐渐褪色,体现了  的漂白性
C . 试管③中溶液逐渐褪色,体现了
的漂白性
C . 试管③中溶液逐渐褪色,体现了  的还原性
D . 试管④中溶液出现浑浊,体现了
的还原性
D . 试管④中溶液出现浑浊,体现了  的氧化性
的氧化性
 的生成
B . 试管②中品红溶液逐渐褪色,体现了
的生成
B . 试管②中品红溶液逐渐褪色,体现了  的漂白性
C . 试管③中溶液逐渐褪色,体现了
的漂白性
C . 试管③中溶液逐渐褪色,体现了  的还原性
D . 试管④中溶液出现浑浊,体现了
的还原性
D . 试管④中溶液出现浑浊,体现了  的氧化性
的氧化性
下列物质能使品红溶液褪色的是( )
①干燥的Cl2 ②Na2O2 ③NaClO ④活性炭 ⑤SO2
A . 除①外其它都可以
B . 只有②③⑤
C . 只有①④⑤
D . 全部
下列说法错误的是( )
A . 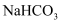 可用于配制发酵粉,医疗上也可以用作治疗胃酸过多
B .
可用于配制发酵粉,医疗上也可以用作治疗胃酸过多
B . 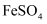 可用于治疗贫血,还是优良的净水剂
C .
可用于治疗贫血,还是优良的净水剂
C .  具有漂白性,可用于漂白紫色石蕊试液
D .
具有漂白性,可用于漂白紫色石蕊试液
D .  可用于感光材料
可用于感光材料
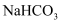 可用于配制发酵粉,医疗上也可以用作治疗胃酸过多
B .
可用于配制发酵粉,医疗上也可以用作治疗胃酸过多
B . 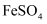 可用于治疗贫血,还是优良的净水剂
C .
可用于治疗贫血,还是优良的净水剂
C .  具有漂白性,可用于漂白紫色石蕊试液
D .
具有漂白性,可用于漂白紫色石蕊试液
D .  可用于感光材料
可用于感光材料
某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。甲同学取agCu片和12mL18mol/L浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的硫酸和Cu剩余。

-
(1) A装置盛放有Cu的仪器名称:,C装置收集气体的方法为:。
-
(2) D中试管口放置的棉花中应浸一种液体,这种液体是,其作用是。
-
(3) 装置B的作用是贮存多余的气体。当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,装置A仍有气体产生,此时装置B中试剂瓶中液面下降,长颈漏斗中液面上升。装置B中应放置的液体是(填字母)。
a.饱和Na2SO3溶液 b.酸性KMnO4溶液 c.饱和NaHSO3溶液 d.浓溴水
-
(4) 反应完毕后,烧瓶中还有一定量的余酸,却不能使Cu完全溶解的原因是。加入足量的下列药品不能证明反应结束后烧瓶中还有硫酸剩余的是(填字母)。
a.NaCl溶液 b.Fe粉 C.CuO d. Na2SO3溶液
-
(5) SO2是形成酸雨的主要物质,对环境污染很大,为了减少工业上煤、石油等燃烧产生SO2的排放,可用氨水将SO2转化为NH4HSO3 , 再氧化成(NH4)2SO4来脱除烟气中的SO2 , 请写出NH4HSO3溶液在空气中氧化成(NH4)2SO4的离子反应方程式:。
下列能使湿润的红色石蕊试纸变蓝的气体是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
化学与生活密切相关,下列有关说法正确的是( )
A . 二氧化硫具有漂白性,可大量用于漂白银耳
B . 冬奥会的火炬外壳使用了新型有机非金属材料——碳纤维复合材料
C . 单晶硅可用于制造光导纤维
D . 液氨汽化吸收大量的热,可用作制冷剂
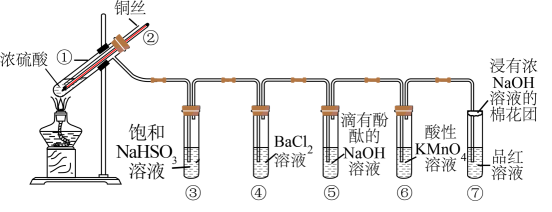
下图是铜与浓硫酸反应并验证其产物性质的装置图。请回答下列问题。
-
(1) 试管①中发生反应的化学方程式为;其中硫酸发生了(填“氧化”或“还原”)反应。
-
(2) 一段时间后,④中溶液无明显现象,⑤⑥⑦溶液均褪色,试管⑤⑥⑦中的现象分别说明SO2具有、、漂白性。
-
(3) 下列说法正确的是(填字母)。
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物
 , 可立刻向试管①中加水,观察颜色
, 可立刻向试管①中加水,观察颜色 -
(4) 充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中
 变大的是(填字母)。
变大的是(填字母)。a.
 b.
b. c.
c.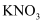
-
(5) 反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为。
最近更新



