二氧化硫的漂白作用 知识点题库
某无色透明的混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此混合气体通过品红溶液后,品红溶液褪色,向剩余气体中通入空气,很快变为红棕色。下列对于原混合气体成分的判断中正确的是
A . 肯定有SO2、O2和NO
B . 肯定没有Cl2、O2和NO2
C . 可能有Cl2和O2
D . 肯定只有NO
能证明SO2具有漂白性的是( )
A . 酸性KMnO4溶液中通入SO2气体后溶液褪色
B . 滴入酚酞的NaOH溶液中通入SO2气体红色消失
C . 品红溶液中通入SO2气体红色消失
D . 溴水中通入SO2气体后溶液褪色
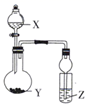
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
-
(1) 实验室用装置A制备SO2 . 某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是.
-
(2) 实验室用装置E制备Cl2 , 其反应的离子方程式为;若有6mol的HCl参加反应,则转移的电子总数为.
-
(3) 停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:,D:.
-
(4) 另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用化学方程式表示).
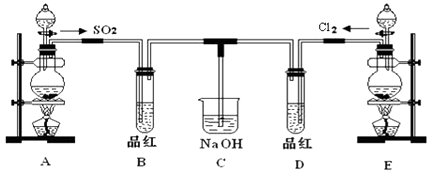
实验室用下列装置制取二氧化硫,并进行实验。根据实验回答问题。
-
(1) A中反应的化学方程式是,该反应中浓H2SO4表现的性质是。
A.只有氧化性 B.只有酸性 C.氧化性和酸性
-
(2) 实验时,B、C、D中的溶液都褪色,期中SO2表现漂白性的(用B、C、D填空),另两个反应中SO2表现性。
-
(3) C中反应的离子方程式如下。请用双线桥标出电子转移情况并填空 。
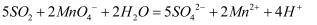
若C中
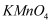 溶液的体积是50mL,当反应中转移0.05mol单子是,溶液紫红色刚好完全褪去,则
溶液的体积是50mL,当反应中转移0.05mol单子是,溶液紫红色刚好完全褪去,则 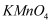 溶液的物质的量浓度是
溶液的物质的量浓度是 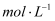 。
。 -
(4) 实验时,D中反应的离子方程式是。
-
(5) 实验时,E中反应的离子方程式是, 。
-
(6) 实验时,F中观察到的显现是。
-
(7) 实验时,G中观察到有淡黄色沉淀生成,反应的化学方程式是。
-
(8) 若让你从以下试剂中推荐替代H中的
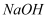 ,你最不推荐的是,请阐述你不推荐的原因。
,你最不推荐的是,请阐述你不推荐的原因。 A.
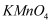 溶液 B.澄清石灰水 C.浓溴水
溶液 B.澄清石灰水 C.浓溴水 -
(9) 若用50mL 4.0
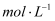
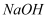 溶液吸收
溶液吸收  气体,将吸收
气体,将吸收  后的溶液进行真空低温蒸发并干燥至恒重(防止分解、氧化),得到白色固体。
后的溶液进行真空低温蒸发并干燥至恒重(防止分解、氧化),得到白色固体。 ①这些
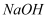 最多可以吸收标准状况下的
最多可以吸收标准状况下的  的体积是多少(不计水溶解的
的体积是多少(不计水溶解的  )?
)?②若白色固体是纯净物,则其质量可能是多少?
③若称得白色固体的质量是16.7g,请通过计算确认白色固体的成分及质量。
(以上①、②、③个问题请写出计算过程)
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A . 加热时,①中上部汇集了NH4Cl固体
B . 加热时,②中溶液变红,冷却后又都变为无色
C . 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D . 三个“封管实验”中所发生的化学反应都是可逆反应
Cl2和SO2都具有漂白作用,若将等物质的量的这两种气体混合通入品红与BaCl2的混合溶液中,能观察到的现象是:( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A . ①②
B . ①③
C . ②③
D . ②④
二氧化硫能够使品红溶液褪色,表现了二氧化硫的( )
A . 氧化性
B . 还原性
C . 漂白性
D . 酸性氧化物的性质
实验室里研究不同价态硫元素之间的转化
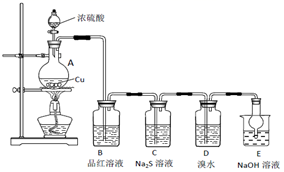
-
(1) A中发生反应的化学方程式为。
-
(2) B中的现象是。
-
(3) C中出现淡黄色沉淀,反应中Na2S做 (填“氧化剂”或“还原剂”)。
-
(4) D溴水褪色,该反应S元素的价态变化是由+4价变为价。
-
(5) 某同学认为D中换成H2O2溶液也可以实现上述硫元素的价态转化,并通过实验进一步证明了他的观点。实验方案和现象为:取D中反应后的溶液于试管中,。
-
(6) E的作用是,离子方程式为。
-
(7) 上述实验体现SO2 的性质有。
下列实验的现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将新制氯水滴到淀粉KI试纸上 | 试纸变蓝色 | 氧化性:I2>Cl2 |
| B | 将过量的CO2通入CaCl2溶液中 | 产生白色沉淀 | 酸性:HCl>H2CO3 |
| C | FeSO4溶液中滴入酸性高锰酸钾溶液 | 紫色褪色 | Fe2+有还原性 |
| D | SO2通入溴水中 | 溶液褪色 | SO2有漂白性 |
A . A
B . B
C . C
D . D
某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
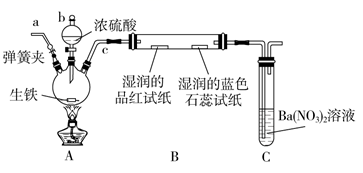
-
(1) 按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为;实验过程中,装置B中观察到的现象是;装置C中有白色沉淀生成,该沉淀是(填化学式)。
-
(2) 装置A中还会产生CO2气体,请写出产生CO2的化学方程式:。
-
(3) 为了验证装置A中产生的气体中含有CO2 , 应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为(填序号);然后再进行的操作是从a处多次鼓入N2 , 其目的是。
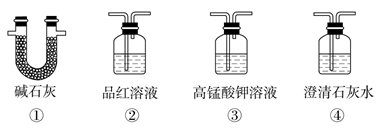
-
(4) 某同学发现实验后期装置A中产生的气体中还含有H2 , 理由是 (用离子方程式表示)。
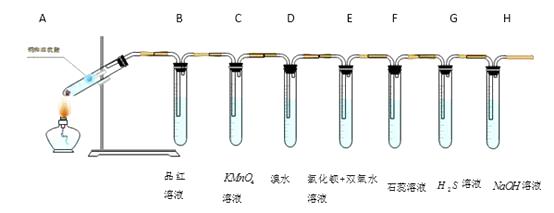
某化学兴趣小组设计如下图所示的实验装置,探究SO2的性质。[部分夹持仪器已略去]
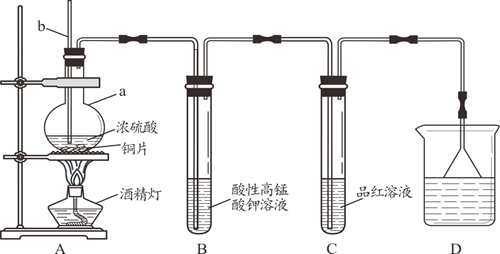
-
(1) [实验探究]
装置A中反应的化学方程式是,仪器a的名称是,导管b的作用是。
-
(2) 实验一段时间后,装置B中观察到现象是。
-
(3) 装置C中溶液褪色说明SO2具有性。
-
(4) 装置D烧杯中盛放的试剂是(填“氢氧化钠溶液”或“浓硫酸”)。
-
(5) 实验结束时需从导管b通入大量空气,其目的是。
-
(6) 用12.8g铜与足量浓硫酸反应,理论上最多可生成LSO2气体(标准状况下)。
-
(7) [知识拓展]
酸雨造成的危害是:(举一例)。
-
(8) 探究SO2形成硫酸型酸雨的途径:将SO2通水入中,测得所得溶液的pH7(填“>”“=”或“<”)。然后每隔1h测定其pH,发现pH逐渐变小,直至恒定,其原因)是(用化学方程式表示)。
如图所示实验装置,将液体X逐滴加入到固体Y中。下列有关实验现象或结论正确的是( )
| 选项 | X | Y | Z | Z实验现象或结论 | 装置 |
| A | 稀硫酸 | 亚硫酸钠 | 品红溶液 | SO2能氧化品红 | |
| B | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 | |
| C | 浓盐酸 | 石灰石 | 硅酸钠溶液 | 非金属性:C>Si | |
| D | 稀硫酸 | 硫化亚铁 | 硫酸铜溶液 | 无明显现象,弱酸不能制强酸 |
A . A
B . B
C . C
D . D
下列说法错误的是( )
A . 工业上常用二氧化硫来漂白纸浆、毛、丝等
B . 硫酸可用于生产化肥、农药、炸药、染料和盐类等
C . 液氨汽化时吸收大量的热,可用作制冷剂
D . 铵盐受热升华为气体,遇冷凝华为铵盐
化学与生产、生活密切相关。下列说法错误的是( )
A . 工业生产玻璃、水泥和陶瓷,均需用石灰石作原料
B . 二氧化硫可做漂白剂、防腐剂,还是一种食品添加剂
C . 汽车尾气中的氮氧化物与碳氢化合物反应可形成光化学烟雾
D . “超轻海绵”使用的石墨烯是新型无机非金属材料
下列说法错误的是( )
A . 二氧化硫可以使石蕊试剂褪色
B . 氧化镁可用于制造耐高温材料
C . 把固体炸药制成胶体能提高威力
D . 二氧化氯可用于自来水的消毒
化学与生活、生产息息相关,下列说法正确的是( )
A . 氧化铁可以用作外墙涂料
B . 二氧化硅可以用作干燥剂
C . 二氧化硫常常用作食品增白
D . 氢氧化铝常用作高温耐火材料
现有下列十种物质:①氯气②小苏打③固体纯碱④二氧化硫⑤蔗糖⑥氢氧化钾⑦氢氧化铁胶体⑧氨水⑨空气⑩浓硫酸
-
(1) 上述十种物质中,属于电解质的有,属于非电解质的有。(用序号填空,下同)
-
(2) 能使品红溶液褪色的是,能使酚酞溶液变红的是。
-
(3) 在⑤中加入⑩时,观察到蔗糖变黑、体积膨胀并放出刺激性气味气体的现象,体现了⑩的性质。
某小组同学设计实验实现几种价态硫元素的转化。
任务I:从以下试剂中选择合适的试剂实现 →
→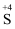 的转化。
的转化。
试剂清单:①浓H2SO4②稀H2SO4③酸性KMnO4溶液④品红⑤Cu
-
(1) 写出实现转化的化学方程式。
-
(2) 设计实验证明实现了该转化(写出操作和现象)。
任务II:实现硫元素在不同价态之间的转化。
 溶液
溶液 SO2
SO2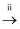 Na2SO3溶液
Na2SO3溶液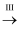 Na2SO4溶液
Na2SO4溶液 -
(3) 欲制备Na2S2O3 , 从氧化还原角度分析,合理的是____(填字母)。A . Na2S+S B . Na2SO3+S C . Na2SO3+Na2SO4 D . SO2+Na2SO4
-
(4) 转化Ⅱ中加入的物质可以是。(填物质类别)
-
(5) 转化Ⅲ可以通入氧气来实现,写出相应离子方程式。
下图是实验室制取二氧化硫并验证其部分性质的装置,下列说法错误的是( )
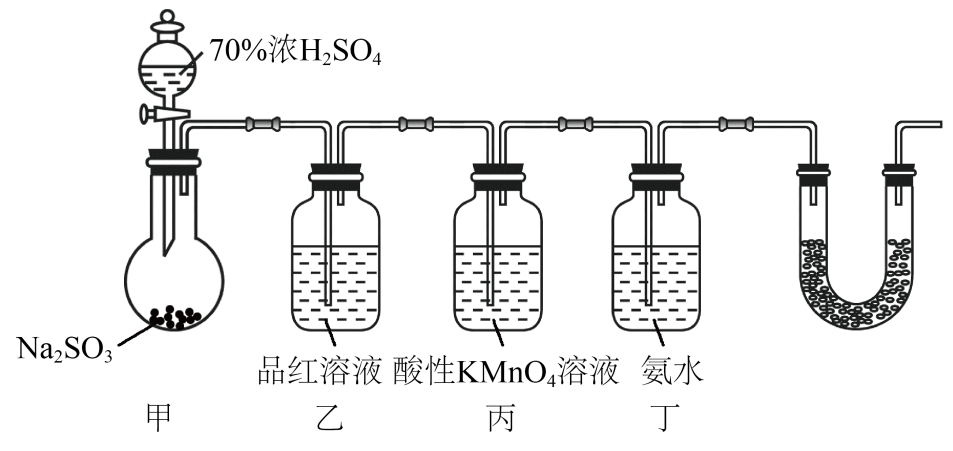
A . 甲装置中,使用70%的浓硫酸既可以加快反应速率又有利于生成的 逸出
B . 乙装置中使用品红溶液是用来验证
逸出
B . 乙装置中使用品红溶液是用来验证 的漂白性
C . 丙装置中使用酸性
的漂白性
C . 丙装置中使用酸性 溶液是用来验证
溶液是用来验证 的还原性
D . 丁装置中过量的氨水吸收
的还原性
D . 丁装置中过量的氨水吸收 气体可以生成亚硫酸氢铵
气体可以生成亚硫酸氢铵
 逸出
B . 乙装置中使用品红溶液是用来验证
逸出
B . 乙装置中使用品红溶液是用来验证 的漂白性
C . 丙装置中使用酸性
的漂白性
C . 丙装置中使用酸性 溶液是用来验证
溶液是用来验证 的还原性
D . 丁装置中过量的氨水吸收
的还原性
D . 丁装置中过量的氨水吸收 气体可以生成亚硫酸氢铵
气体可以生成亚硫酸氢铵
下列判断正确的是( )
A . 将SO2通入少量酸性高锰酸钾溶液,高锰酸钾溶液褪色,证明SO2具有漂白性
B . 室温下,分别将铝片与铁片浸入浓硝酸中可以比较铝、铁的金属性强弱
C . 将NH3通过灼热的氧化铜固体,固体由黑色变为红色,证明NH3具有还原性
D . 向某溶液中加入BaCl2溶液,有白色沉淀生成,再滴加过量稀盐酸,沉淀不溶解,则该溶液中一定含有SO

最近更新