硫酸根离子的检验 知识点题库
现 象 | 解 释 | |
A | Na2O2 投入到 FeCl2 溶液中得到大量红褐色沉淀 | Na2O2 具有还原性 |
B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
C | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42﹣ |
D | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
甲的实验为:试样A(无色溶液) 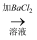 白色沉淀
白色沉淀 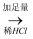 沉淀不溶解
沉淀不溶解
①乙认为甲的实验不严谨,因为试样A中若含有离子(仅填一种),也会有此现象.乙的实验为:试样B(无色溶液)  白色沉淀
白色沉淀  沉淀不溶解
沉淀不溶解
②丙认为乙的实验也不严谨,因为试样B中若含有离子(仅填一种),也会有此现象.丙的实验为:试样C(无色溶液) 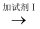 现象Ⅰ
现象Ⅰ 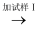 现象Ⅱ
现象Ⅱ
若丙方案合理,则回答:
③其中试剂Ⅰ是,现象Ⅰ是;试剂Ⅱ是,现象Ⅱ是(若认为丙方案不合理,以上四空可以不填).
| 选项 | 实验操作 | 实验目的或结论 |
| A | 高温下,Na2CO3与SiO2反应 | H2SiO3的酸性比H2CO3的酸性强 |
| B | 取少量KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 | 检验KClO3中的氯元素 |
| C | 向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失 | 说明原溶液中一定含有CO32- 或 SO32- |
| D | 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤 | 除去Mg(OH)2样品中的Ca(OH)2 |
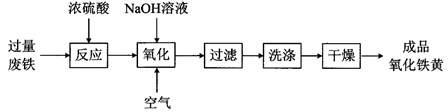
-
(1) 氧化铁黄中铁元素的化合价为,废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是 (写离子方程式)。
-
(2) 氧化过程生成氧化铁黄的化学方程式是。
-
(3) 上述流程中,检验“洗涤”是否完全的方法是。
-
(4) 氧化时应控制pH的合理范围是3.5-4.0,pH过小导致氧化铁黄产率较低的可能原因是。
| 实验操作 | 实验现象 | 结论 | |
| A | 铜与浓硝酸反应,生成的气体用湿润的KI-淀粉试纸检验 | 试纸变蓝 | NO2为酸性气体 |
| B | 向某溶液中加入稀盐酸酸化的BaCl2溶液 | 有白色 沉淀产生 | 该沉淀可能是BaSO4 , 该溶液中可能含有SO42- |
| C | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 溶液一定是浓盐酸 |
| D | 向某溶液中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液中一定含有SO32-或CO32- |
 、
、  、Cl-.检验其中是否含有
、Cl-.检验其中是否含有  ,除BaCl2溶液外,还需要的溶液是( )
,除BaCl2溶液外,还需要的溶液是( )
 B . 为了使阿司匹林晶体能从过饱和溶液中析出,可用玻璃棒摩擦与溶液接触处的容器壁
C . 用容量瓶配制溶液,定容时仰视刻度,所配溶液浓度偏大
D . 有机溶剂乙醇、丙酮、四氯化碳等极易被引燃,使用时需远离火源
B . 为了使阿司匹林晶体能从过饱和溶液中析出,可用玻璃棒摩擦与溶液接触处的容器壁
C . 用容量瓶配制溶液,定容时仰视刻度,所配溶液浓度偏大
D . 有机溶剂乙醇、丙酮、四氯化碳等极易被引燃,使用时需远离火源
| 选项 | 实验操作和现象 | 实验结论 |
| A | 常温下,将大小、形状形态的锌和铝分别加入到等体积 | 锌比铝活泼 |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀 | 该溶液中一定含有 |
| C | 将盐酸滴入碳酸钠溶液中,产生气泡 | 非金属性:Cl大于C |
| D | 向某溶液中加入氢氧化钠溶液丙加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有 |
 C . 向某溶液中加入少量新制氯水后再加几滴KSCN溶液,溶液变为红色,说明原溶液中含有Fe2+
D . 向某溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀生成,则该溶液中含
C . 向某溶液中加入少量新制氯水后再加几滴KSCN溶液,溶液变为红色,说明原溶液中含有Fe2+
D . 向某溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀生成,则该溶液中含 
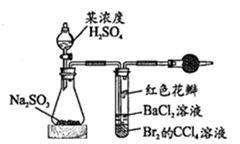
 生成
生成
 和
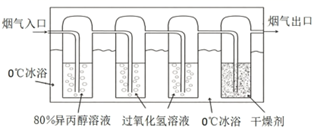
和  等物质,用如图装置测定
等物质,用如图装置测定  含量。已知异丙醇溶液可选择性吸收
含量。已知异丙醇溶液可选择性吸收  并转化为
并转化为  ,也可溶解少量
,也可溶解少量  ,实验中应尽快除去
,实验中应尽快除去  。
。 
下列说法错误的是( )
 B . 通过测定
B . 通过测定  的质量检测
的质量检测  含量
C . 该过程中涉及到反应:
含量
C . 该过程中涉及到反应:  D .
D .  冰浴可减少异丙醇的挥发
冰浴可减少异丙醇的挥发
| 选项 | 实验操作和现象 | 结论 |
| A | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀 | 该溶液中一定含有 |
| B | 用pH试纸测定浓度均为0.1mol·L-1HCOONa溶液与CH3COONa溶液的pH,CH3COONa溶液的pH较大 | CH3COOH电离出H+的能力比HCOOH的强 |
| C | 向0.1mol·L-1H2O2溶液中滴加0.1mol·L-1KMnO4溶液,溶液褪色并放出能使带火星木条复燃的气体 | H2O2具有氧化性 |
| D | 向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3溶液,振荡,出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 向某溶液中先加入几滴KSCN溶液,无明显现象,再滴加少量新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 | 该溶液中一定含有CO32- |
| D | 向某溶液加入硝酸银溶液,有白色沉淀产生 | 该溶液中一定含有Cl- |
-
(1) 从氮元素的价态角度分析,NO有性。
-
(2) 以Cu和HNO3为原料制备NO,反应的化学方程式为。
-
(3) 设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性Na2SO3溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性Na2SO3溶液会发生氧化还原反应,NO被还原为N2O
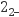 。
。ⅱ.Ag+与N2O
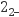 反应生成黄色沉淀。
反应生成黄色沉淀。①检验SO
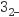 的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,(填操作和实验现象)。
的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,(填操作和实验现象)。②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,(填实验现象)。
上述实验证明NO有氧化性。
实验Ⅱ的目的是。
③写出NO与碱性Na2SO3溶液反应的离子方程式。
④从电极反应角度分析NO与碱性Na2SO3溶液的反应。
还原反应:2NO+2e-=N2O
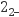
氧化反应:。
实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和Na2SO3溶液和加有NaOH的饱和Na2SO3溶液中,后者集气瓶中液面上升更快。
根据上述实验所得结论:。
-
(4) 某同学结合所学知识设计处理工业废气中SO2和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的SO2 , 反应的化学方程式是。
②再向生成的溶液中加入一定量,以此溶液来吸收NO气体。
-
(1) 锻烧黄铁矿的化学方程式为。
-
(2) 将尾气净化所得SO2 , 边搅拌边通入NaOH溶液中制备NaHSO3溶液。溶液中H2SO3、HSO
 、SO
、SO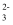 随pH的分布如图所示,要得到较为纯净的 NaHSO3溶液,应采取的实验操作为。
随pH的分布如图所示,要得到较为纯净的 NaHSO3溶液,应采取的实验操作为。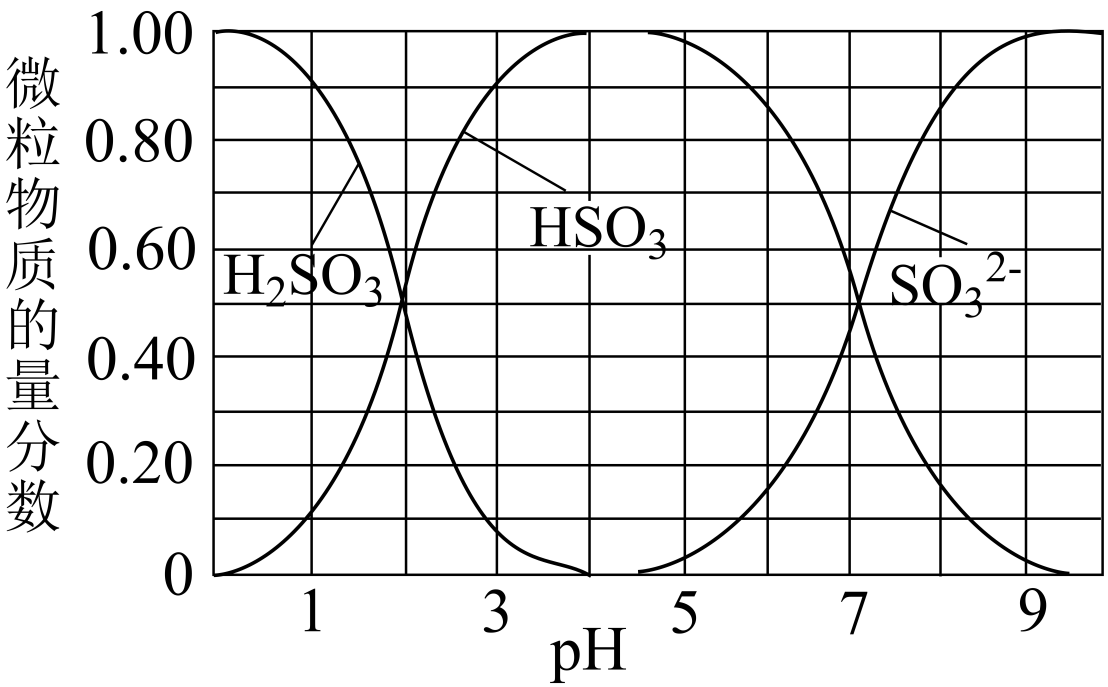
-
(3) 焦亚硫酸钠(Na2S2O5)与强酸反应放出SO2 , 加热NaHSO3溶液可制备焦亚硫酸钠,所得产品中可能含有Na2SO4.检验产品中是否含有SO
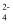 的操作为。
的操作为。
-
(4) 炉渣中的Fe2O3可制备还原铁粉。还原铁粉纯度可通过下列方法测定:称取0.280 0 g 样品,溶于过量稀硫酸,平行三次用标准K2Cr2O7溶液滴定所得溶液中的Fe2+ , 平均 消耗0.030 00 mol·L-1的K2Cr2O7溶液25.10 mL (测定过程中杂质不参与反应)。
① 写出滴定反应的离子方程式。
② 计算还原铁粉的纯度(写出计算过程)。
 的浓硫酸中,观察到前者反应速率快
的浓硫酸中,观察到前者反应速率快


