硫酸根离子的检验 知识点题库
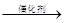 C+NO2
C . 浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体
D . 因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸
C+NO2
C . 浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体
D . 因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸
 、
、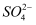 , 要求依次检验出这三种离子,请完成下列实验设计:
, 要求依次检验出这三种离子,请完成下列实验设计:检验离子 | 所加试剂 | 实验现象 | 离子方程式 |
① | 稀硝酸 | ||
② | 产生白色沉淀 | ||
③ Cl- | 产生白色沉淀 |
甲、乙、丙三位同学各设计一个实验,结果各自都认为自己的试样中含有SO42﹣ .
甲的实验为:试样A(无色溶液) 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解
①乙认为甲的实验不严谨,因为试样A中若含有 离子(仅填一种),也会有此现象.乙的实验为:试样B(无色溶液)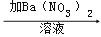 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解
②丙认为乙的实验也不严谨,因为试样B中若含有 离子(仅填一种),也会有此现象.丙的实验为:试样C(无色溶液) 现象Ⅰ
现象Ⅰ 现象Ⅱ
现象Ⅱ
若丙方案合理,则回答:
③其中试剂Ⅰ是 ,现象Ⅰ是 ;试剂Ⅱ是 ,现象Ⅱ是 (若认为丙方案不合理,以上四空可以不填).
选项 | 实验 | 现象 | 结论或解释 |
A | 将0.1 mol·L-1 MgSO4溶液滴入过量NaOH溶液,再滴加几滴0.1 mol·L-1 CuSO4溶液 | 先有白色沉淀生成,后有蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
B | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 下来 | 铝箔表面有致密Al2O3薄膜,且Al2O3的熔点高于Al |
C | 向新收集的酸雨中滴加硝酸钡溶液 | 产生白色沉淀 | 酸雨中一定含有SO42- |
D | 取久置的Na2O2粉末,向其中 滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |

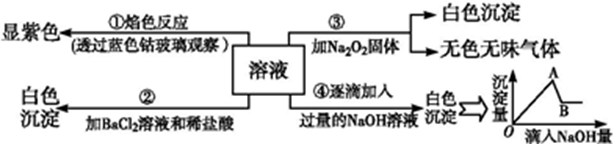
请你根据上图推断:
-
(1) 原溶液中一定存在的阴离子有,显(填“酸”“碱”或“中”)性。
-
(2) 实验③中产生无色无味气体所发生的化学方程式为。
-
(3) 写出实验④中A点对应沉淀的化学式:。
-
(4) 写出实验④中,由A→B过程中所发生反应的离子方程式:。
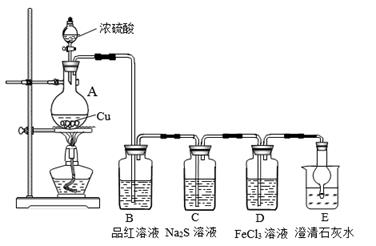
-
(1) 仪器 A 的名称是。
-
(2) 该实验装置有一处试剂选择明显错误,请指出并改进。
-
(3) 装置 D 中发生反应的离子方程式是。
-
(4) 请设计实验方案验证装置D 中硫元素的价态变化。
-
(5) 下列说法不正确的是( )。A . 装置 B 中溶液红色褪去,体现 SO2 的漂白性;取褪色后溶液加热,又恢复红色 B . 装置 C 中出现淡黄色浑浊,体现 SO2的氧化性;最终溶液中溶质为 Na2SO3 C . 装置 D 中棕黄色溶液变为无色,体现 SO2的还原性;反应后溶液酸性增强 D . 装置 A 和B 之间应加装一个安全瓶以防止倒吸,避免引起实验事故
-
(1) (实验1)制备银镜:
i.配制银氨溶液,需要的试剂是。并取等量银氨溶液于多支试管中。
ii.向银氨溶液中加入等量的葡萄糖溶液,水浴加热。产生银镜,洗净,备用。 -
(2) (实验2)溶解银镜:分别向两支试管中加入5mLFe(NO3)3、Fe2(SO4)3溶液。
选用Fe2(SO4)3溶液的浓度为0.05mol/L,目的是保证相等。编号 a b 试剂 0.1mol/LFe(NO3)3 0.05mol/LFe2(SO4)3 现象 银镜消失较快; 溶液黄色略变浅; 产生少许白色沉淀 银镜消失较慢; 溶液黄色明显变浅; 产生较多白色沉淀 -
(3) 从a、b中均检出了Fe2+ , 说明Fe3+具有氧化性。a中Fe3+氧化Ag的离子方程式是。
-
(4) 确认b中沉淀为Ag2SO4(微溶),检验Ag2SO4固体中
 的方法是。
的方法是。
-
(5) 推测在a中的酸性条件下
 氧化了银,证据是。通过如下实验验证了推测是合理的:
氧化了银,证据是。通过如下实验验证了推测是合理的:
i.测pH:测定实验a中所用Fe(NO3)3溶液的pH=2;
ii.配制溶液:。取5mL此溶液加入有银镜的试管,现象是。
请将步骤ii补充完整。
-
(6) 分析a中白色沉淀的成分,提出假设。
假设1:Fe(OH)2;假设2:AgNO2;假设3:…
①设计实验方案验证假设1:取少量沉淀置于空气中,未变色。假设1不成立。
②设计实验方案验证假设2(已知:亚硝酸盐能与酸化的KI溶液反应)。
实验方案
预期现象和结论
(实验结论与讨论)铁盐能蚀刻银;
 能提高铁盐的蚀刻能力。推测硝酸铁溶液如果保持足够的酸性,可以避免产生沉淀。
能提高铁盐的蚀刻能力。推测硝酸铁溶液如果保持足够的酸性,可以避免产生沉淀。
 B . 某溶液加入NaOH溶液,将湿润红色石蕊试纸靠近试管口无颜色变化,则溶液中一定不含
B . 某溶液加入NaOH溶液,将湿润红色石蕊试纸靠近试管口无颜色变化,则溶液中一定不含  C . 某溶液中加入AgNO3溶液,再加足量的稀HNO3仍有白色沉淀,说明溶液中一定有Cl-
D . 某无色溶液通过焰色反应并透过蓝色钴玻璃看到火焰呈紫色,则该溶液中一定含钾盐
C . 某溶液中加入AgNO3溶液,再加足量的稀HNO3仍有白色沉淀,说明溶液中一定有Cl-
D . 某无色溶液通过焰色反应并透过蓝色钴玻璃看到火焰呈紫色,则该溶液中一定含钾盐
| 实验 | 现象 | 结论 | |
| A | 向0.1mol/L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH值 | 前者的pH值比 后者的大 | 碳酸的酸性强于亚硫酸 |
| C | 向某溶液中加入硝酸酸化的氯化钡溶液 | 溶液中有白色沉淀 | 溶液中含有SO |
| D | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN⇌Fe(SCN)3+3KCl平衡向逆反应方向移动 |
 C . 用向下排空气法收集一瓶干燥而纯净的氯气
D . 将盛满氯气的试管倒扣在水槽中,检测其在水中的溶解性
C . 用向下排空气法收集一瓶干燥而纯净的氯气
D . 将盛满氯气的试管倒扣在水槽中,检测其在水中的溶解性
 溶液有白色沉淀,再加盐酸,沉淀不消失,则该溶液中一定有
溶液有白色沉淀,再加盐酸,沉淀不消失,则该溶液中一定有 B . 不慎将酸沾到皮肤上,应立即用大量水冲洗,然后用3%-5%的碳酸氢钠溶液冲洗
C . 纯净的
B . 不慎将酸沾到皮肤上,应立即用大量水冲洗,然后用3%-5%的碳酸氢钠溶液冲洗
C . 纯净的 在
在 中安静地燃烧,发出苍白色火焰,瓶口上方有白色烟雾
D . 将铂丝用硫酸清洗后在外焰上灼烧至与原来火焰颜色相同时,再进行焰色试验
中安静地燃烧,发出苍白色火焰,瓶口上方有白色烟雾
D . 将铂丝用硫酸清洗后在外焰上灼烧至与原来火焰颜色相同时,再进行焰色试验
实验目的 | 实验过程 | |
A | 检验某溶液中是否含有SO | 取少量溶液于试管中,加入BaCl2溶液,出现白色沉淀,再加入足量盐酸,观察沉淀的变化 |
B | 探究浓度对反应速率的影响 | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 |
C | 探究H2O2氧化性比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,观察实验现象 |
D | 检验某固体试样是否含有Cl- | 取少量固体试样溶于水,先加入足量稀硝酸,再滴加AgNO3溶液,观察实验现象 |
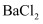 溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定含有
溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定含有 D . 在制备
D . 在制备 胶体实验中,持续加热和不断搅拌可使反应更充分
胶体实验中,持续加热和不断搅拌可使反应更充分




