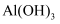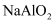含硫物质的性质及综合应用 知识点题库
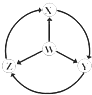
选项 | W | X | Y | Z |
|
A | S | SO2 | SO3 | H2SO4 | |
B | Na | Na2O2 | NaOH | NaCl | |
C | Fe | FeCl3 | Fe(OH)2 | FeCl2 | |
D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
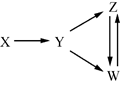
| 选项 | X | Y | Z | W |
| A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| B | Fe3O4 | Fe | FeCl2 | FeCl3 |
| C | H2SO4 | SO2 | S | SO3 |
| D | N2 | NH3 | NO | NO2 |
-
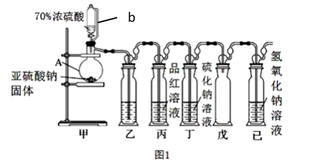
(1) Ⅰ.某研究小组设计了一套制备及检验 SO2 部分性质的装置,如图 1 所示。
仪器 A 的名称,导管 b 的作用。
-
(2) 装置乙的作用是为了观察生成 SO2的速率,则装置乙中加入的试剂是。
-
(3) ①实验前有同学提出质疑:该装置没有排空气,而空气中的 O2 氧化性强于 SO2 , 因此 装置丁中即使有浑浊现象也不能说明是 SO2 导致的。请你写出 O2 与 Na2S 溶液反应的化学 反应方程式。
②为进一步检验装置丁产生浑浊现象的原因,进行新的实验探究。实验操作及现象见表。
序号
实验操作
实验现象
1
向 10ml 1mol·L-1 的 Na2S 溶液中通 O2
15min 后,溶液才出现浑浊
2
向 10ml 1mol·L-1 的 Na2S 溶液中通 SO2
溶液立即出现黄色浑浊
由实验现象可知:该实验条件下 Na2S 溶液出现浑浊现象是 SO2 导致的。你认为上表实验 1 反应较慢的原因可能是。
-
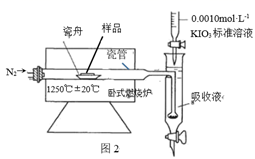
(4) Ⅱ.铁矿石中硫元素的测定可以使用燃烧碘量法,其原理是在高温下将样品中的硫元素转化 为 SO2 , 以 淀 粉 和 碘 化 钾 的 酸 性 混 合 溶 液 为 SO2 吸 收 液 , 在 SO2 吸 收 的 同 时 用 0.0010mol·L-1KIO3 标准溶液进行滴定,检测装置如图 2 所示:
[查阅资料] ①实验进行 5min,样品中的 S 元素都可转化为 SO2
②2IO3-+5SO2+4H2O=8H++5SO42-+I2
③I2+SO2+2H2=2I-+SO42-+4H+
④IO3-+5I-+6H+=3I2+3H2O
工业设定的滴定终点现象是。
-
(5) 实验一:空白试验,不放样品进行实验,5min 后测得消耗标准液体积为 V1mL
实验二:加入 1g 样品再进行实验,5min 后测得消耗标准液体积为 V2mL
比较数据发现 V1 远远小于 V2 , 可忽略不计 V1。 测得 V2 的体积如表
序号
1
2
3
KIO3 标准溶液体积/mL
10.02
9.98
10.00
该份铁矿石样品中硫元素的质量百分含量为。
-
(1) 我国化学家姜雪峰因其在绿色有机硫化学领域的杰出贡献被遴选为“全球青年化学家元素周期表硫元素代表”。
①硫元素在元素周期表中的位置是 。
②乙硫醇(CH3CH2SH)是一种含硫有机物,其分子中S-H的极性小于CH3CH2OH分子中O-H的极性,请从原子结构角度解释其原因:。
-
(2) 自然界的硫循环过程如下图所示。

①上图所涉及的含硫物质中,能使品红溶液褪色的是。
②降解石油(主要成分为CxHy)的过程中,在细菌催化作用下,石油与硫酸盐反应转化为碳酸氢盐,硫酸盐做(填“氧化剂”或“还原剂”)。
③煤炭中的硫化物主要为FeS2(S为-1价)。在潮湿的环境中,FeS2可在氧化亚铁硫杆菌(T.f)的作用下被空气氧化为Fe2(SO4)3 , 该反应的化学方程式为。
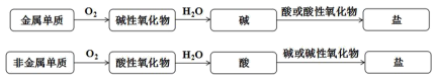
下述转化关系错误的是( )
 Na2O
Na2O  NaOH
NaOH  CH3COONa
B . Mg
CH3COONa
B . Mg  MgO
MgO  MgCl2
MgCl2 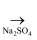 MgSO4
C . C
MgSO4
C . C  CO2
CO2  H2CO3
H2CO3  CaCO3
D . S
CaCO3
D . S  SO2
SO2  H2SO3
H2SO3  Na2SO3
Na2SO3
M+N  Q
Q  Q溶液
Q溶液  M+N
M+N
-
(1) H2SO3 转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移方向和数目:。
-
(2) 常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验 证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于 CuSO4 溶液中,若铁 棒表面,则发生了钝化;若铁棒表面,则未发生反应。
-
(3) 用 Na2SO3 吸收法作为治理 SO2 污染的一种方法,其原理为(用化学方程式表示):。
-
(4) 减少 SO2 的污染并变废为宝,我国正在探索在一定条件下用 CO 还原 SO2 得到单质硫的方法来除去SO2。该反应的化学方程式:。
-
(5) 制取硫酸铜有两种方法:方法一:2Cu+O2
 2CuO,CuO+ H2SO4= CuSO4+H2O,方法二:Cu+2H2SO4(浓)
2CuO,CuO+ H2SO4= CuSO4+H2O,方法二:Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:(答任一点)。
CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:(答任一点)。

-
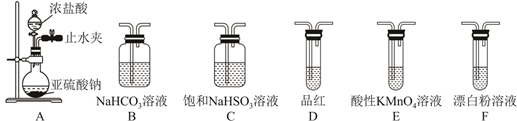
(1) 装置B中的现象为,反应过程中表现了SO2的性。装置C中的现象为,反应过程中表现了SO2的性。
-
(2) 装置D中的有关反应的化学反应方程式为。
-
(3) 装置E中的有关反应的离子方程式为,该反应中,标况下5.6LSO2参加反应,电子转移的物质的量为。
-
(4) 装置F中NaOH溶液的作用是
-
(1) Ⅰ.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成SO2和Cl2.实验室合成SO2Cl2的原理:SO2(g)+Cl2(g)
 SO2Cl2(l) ΔH<0,实验装置如图所示(夹持仪器已省略),请回答下列问题:
SO2Cl2(l) ΔH<0,实验装置如图所示(夹持仪器已省略),请回答下列问题: 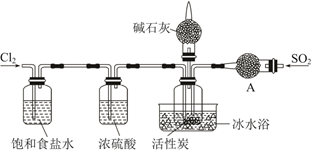
装置A中的试剂是。
-
(2) 活性炭的作用是。
-
(3) 在冰水浴中制备SO2Cl2的原因是。
-
(4) 为了测定SO2Cl2产品纯度(杂质不参与反应),称取a g SO2Cl2产品于锥形瓶中,加入足量蒸馏水,充分反应。用c mol·L-1 AgNO3溶液滴定反应后的溶液,滴几滴K2CrO4溶液做指示剂,当生成Ag2CrO4砖红色沉淀时,认为溶液中Cl-沉淀完全,此时消耗AgNO3溶液的体积为V mL。
①用棕色滴定管盛装AgNO3溶液,其原因是。
②该SO2Cl2产品的纯度为。
-
(5) Ⅱ.选用下面的装置探究酸性:H2SO3>HClO,其连接顺序为A→。能证明H2SO3的酸性强于HClO的实验现象为。
 的叙述正确的是( )
的叙述正确的是( )
 B . 空气吹出法提取海水中的溴常用
B . 空气吹出法提取海水中的溴常用  作氧化剂
C . 将
作氧化剂
C . 将  通入
通入 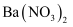 溶液能生成白色沉淀
D .
溶液能生成白色沉淀
D .  具有漂白性,所以能使品红溶液和高锰酸钾酸性溶液褪色
具有漂白性,所以能使品红溶液和高锰酸钾酸性溶液褪色
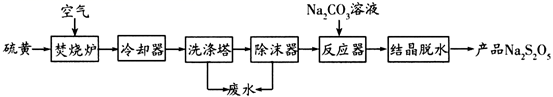
已知:结晶脱水发生的反应: 
回答下列问题:
-
(1) Na2S2O5中硫元素的化合价为。
-
(2) 焚烧炉中反应的化学方程式为。
-
(3) 反应器中发生反应的离子方程式为。
-
(4) 葡萄酒酿造过程中添加Na2S2O5会放出一种有刺激性气味的气体,该气体是一种食品添加剂。实验室中检验该气体的常用试剂是。
-
(5) 废水中的硫单质(S8)能与碱反应,化学反应:
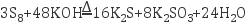 ,反应中氧化剂与还原剂的物质的量之比为。
,反应中氧化剂与还原剂的物质的量之比为。
![]()
-
(1) 若A为硫单质,B为无色且有刺激性气味的有毒气体,则D是(填化学式),B→C的化学反应方程式为。
-
(2) 若A为气态氢化物,B为无色气体,C为一种红棕色气体,则A是(填化学式),A→B的化学反应方程式为。
| A | B | C | D | |
| 气体 | 硫化氢 | 二氧化碳 | 氨气 | 氯化氢 |
| 溶液 | 亚硫酸 | 氯化钙 | 氯化铝 | 硝酸银 |
 具有氧化性
B . 向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ)
C . 向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2
D . 向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应
具有氧化性
B . 向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ)
C . 向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2
D . 向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应
-
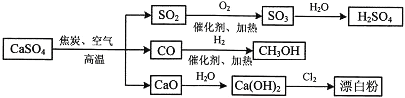
(1) 硫酸是重要的基础化工原料,可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
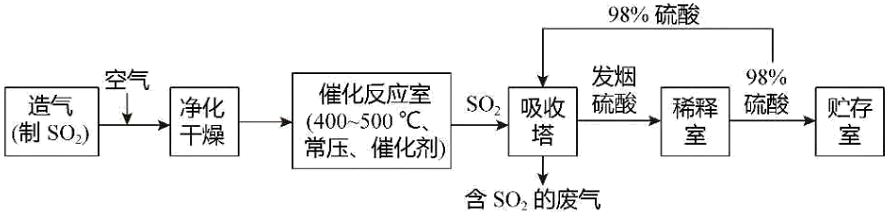
①工业上常以黄铁矿(FeS2)为原料来制备SO2 , 配平该反应的化学方程式
FeS2+ O2
 Fe2O3+ SO2
Fe2O3+ SO2②写出催化反应室中SO2被氧化为SO3的化学方程式。
③硫酸工业的尾气中含有少量SO2 , 若直接排放会污染空气,并导致硫酸型酸雨。下列物质中,能吸收SO2的有(填字母)。
A.氨水B.酸性KMnO4溶液C.生石灰D.Na2CO3溶液
-
(2) 石油加氢精制和天然气净化等过程产生有毒的H2S,直接排放会污染空气。工业上用克劳斯工艺处理含H2S的尾气,并获得硫单质,流程如下:
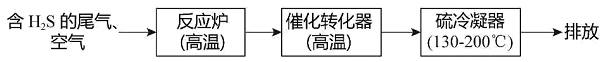
①反应炉中发生反应:2H2S+3O2
 2SO2+2H2O
2SO2+2H2O②催化转化器中发生反应的化学方程式。
③为了提高H2S转化为S的比例,理论上应控制反应炉中H2S的转化率为(填字母)。[转化率=反应的n(A)/起始的n(A)]
A.
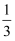 B.
B.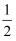 C.
C.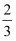 D.1
D.1
 和SO
和SO 进一步氧化得到SO
进一步氧化得到SO 。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(HCO
。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(HCO 和CO
和CO )发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。中和反应过程需要鼓入大量空气。下列说法与通入空气作用无关的是( )
)发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。中和反应过程需要鼓入大量空气。下列说法与通入空气作用无关的是( )
 氧化成为SO
氧化成为SO B . 将产生的CO2赶出水面
C . 提高脱硫海水中的含氧量
D . 提高脱硫海水中碳酸盐的浓度
B . 将产生的CO2赶出水面
C . 提高脱硫海水中的含氧量
D . 提高脱硫海水中碳酸盐的浓度
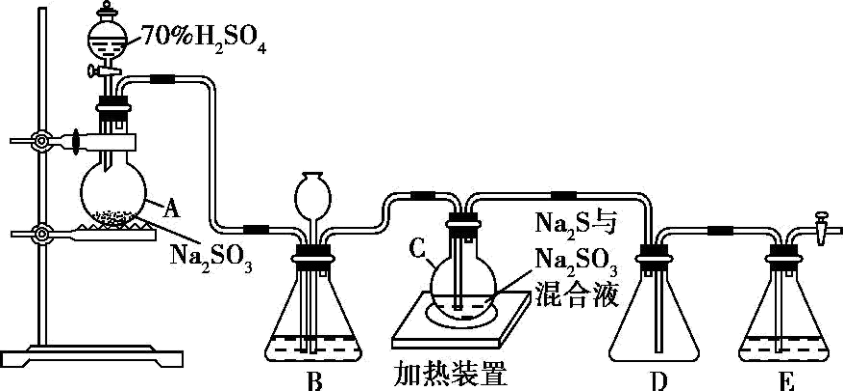
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
回答下列问题:
-
(1) 仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若,则整个装置气密性良好。装置E中为溶液。
-
(2) 为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为。
-
(3) 装置B的作用之一是观察SO2的生成速率,其中的液体最好选择溶液。
-
(4) 实验中,为使SO2缓慢进入烧瓶C,采用的操作是。
-
(5) 已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是。
-
(6) 反应终止后,烧瓶C中的溶液经、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。请设计实验检测产品中是否存在Na2SO4 , 简要说明实验操作、现象和结论:。
-
(7) 烧瓶C中的实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:。
-
(8) 准确称取2.000g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol·L-1碘的标准溶液滴定,反应原理为:2S2O32-+I2=S4O62-+2I-。消耗碘的标准溶液体积为18.00mL,则产品的纯度为(已知Na2S2O3·5H2O的相对分子质量为248)。
| 甲 | 乙 | 丙 | |
| A | | | |
| B | | | |
| C | | | |
| D | | | |