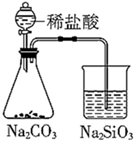
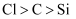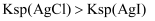中和热的测定 知识点题库

-
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是.
-
(2) 烧杯间填满碎纸条的作用是
-
(3) 大烧杯上如不盖硬纸板,求得的中和热数值.(填“偏大、偏小、无影响”)
-
(4) 如果用60mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”).
简述理由.

-
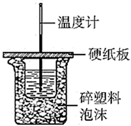
(1) 烧杯间填满泡沫塑料的作用是;
-
(2) 大烧杯上若不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”、“无影响”)
-
(3) 如上图所示,仪器A的名称是;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H﹣57.3KJ/mol(填“>”、“<”或“=”);
-
(4) 实验中改用80mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、“不相等”),所求中和热(填“相等、“不相等”).
-
(5) 用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;(均填“偏大”、“偏小”、“无影响”)
-
(6) 理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式.





实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
-
(1) 填出图中实验仪器的名称A,B.
-
(2) 实验时用A搅拌溶液的方法是.不能用铜丝搅拌棒代替A的理由是.
-
(3) 经数据处理,t2﹣t1=3.4℃.则该实验测得的中和热△H=[盐酸和NaOH溶液的密度按1g•cm﹣3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)﹣1计算].
-
(4) 若将HCl溶液改为相同体积、相同浓度的醋酸,测得中和热为△H1=﹣Q KJ/mol,则Q与57.3的关系为:Q57.3(填“<”、“>”或“=”),理由是.
某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L﹣1 , 盐酸的浓度为0.5mol•L﹣1 , 每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2﹣t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
-
(1) 已知盐酸、NaOH溶液密度近似为1.00g•cm﹣3 , 中和后混合液的比热容c=4.18×10﹣3kJ•g﹣1•℃﹣1 , 则该反应的中和热为△H=.
-
(2) 若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会(填“偏大”、“偏小”或“不变”),其原因是.
-
(3) 在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热(填“偏大”、“偏小”或“不变”).
 分离CCl4和水
B .
分离CCl4和水
B .  酸碱中和滴定
C .
酸碱中和滴定
C .  吸收HCl尾气
D .
吸收HCl尾气
D .  中和热的测定
中和热的测定
①用量筒量取50mL 0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL 0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:

-
(1) 该图中有两处未画出,它们是、。
-
(2) 为什么所用NaOH溶液要稍过量。
-
(3) 倒入NaOH溶液的正确操作是。
-
(4) 现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3 , 则ΔH1、ΔH2、ΔH3的大小关系为。
-
(5) 假设盐酸和氢氧化钠溶液的密度都是1g·cm-3 , 又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验
序号
起始温度t1/ ℃
终止温度t2/ ℃
盐酸
氢氧化钠溶液
混合溶液
1
20.0
20.1
23.2
2
20.2
20.4
23.4
3
20.5
20.6
23.6
依据该学生的实验数据计算,该实验测得的中和热ΔH=(结果保留一位小数)。
-
(6) (填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是。

①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
-
(1) 倒入NaOH溶液的正确操作是_________A . 沿玻璃棒缓慢倒入 B . 分三次少量倒入 C . 一次迅速倒入
-
(2) 使硫酸与NaOH溶液混合均匀的正确操作是__________A . 用温度计小心搅拌 B . 揭开硬纸片用玻璃棒搅拌 C . 轻轻地振荡烧杯 D . 用套在温度计上的环形玻璃棒上下轻轻地抽动
-
(3) 实验数据如下表:
温度
实验次数
起始温度t1℃
终止温度t2/℃
温度差平均值
(t2-t1)/℃
H2SO4
NaOH
平均值
1
26.2
26.0
26.1
29.5
2
27.0
27.4
27.2
32.3
3
25.9
25.9
25.9
29.2
4
26.4
26.2
26.3
29.8
①根据表中数据计算出来温度差的平均值为℃;
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3 , 中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=( 取小数点后一位)。
③上述实验数值结果与中和热为57.3 kJ/mol有偏差,产生偏差的原因可能是。
a.实验装置保温、隔热效果差 b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 c.量取NaOH溶液的体积时仰视读数 d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
| 选项 | 实验操作和现象 | 结论 |
| A | 向NaOH固体中加入少量稀盐酸,测得溶液温度高于室温 | 盐酸与氢氧化钠的反应为放热反应 |
| B | 向Na2SO3溶液中,加入BaCl2溶液,产生白色沉淀,过滤洗涤后,向所得沉淀中加入足量稀硝酸,沉淀不溶解 | 原Na2SO3溶液已变质 |
| C | 向pH=3的醋酸溶液中,加入醋酸铵溶液,溶液pH增大 | 醋酸铵溶液呈碱性 |
| D | 向含有少量CuCl2的MgCl2溶液中,滴加几滴氨水,产生蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| 选项 | A | B | C | D |
| 实验 | | | | |
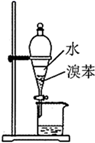
| 实验目的 | 证明非金属性 | 分离溴苯 | 测定中和热 | 证明 |

-
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是。
-
(2) 烧杯间填满碎纸条的作用是。
-
(3) 若某同学进行中和热的测定实验,有些操作不规范,造成测得的结果偏低,请你分析结果偏低的原因可能是 (填字母代号)。A . 测量盐酸和NaOH溶液反应后的温度时,温度计温度达到最高值 B . 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 C . 做本实验的当天,室温较高 D . 在量取盐酸时仰视读数 E . 用温度计测定盐酸起始温度后直接测定NaOH溶液的温度 F . 大烧杯的盖板中间小孔太大
-
(4) 若改用50mL0.50mol•L-1CH3COOH溶液(已知CH3COOH电离时吸热进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”或“无影响”)。