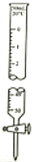中和热的测定 知识点题库
-
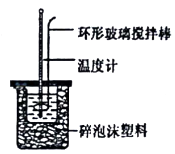
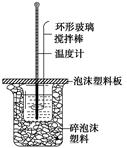
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是.
-
(2) 烧杯间填满碎纸条的作用是.
-
(3) 大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
-
(4) 如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由
-
(5) 用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”).
-
(1) Ⅰ、配制0.50mol/L KOH溶液:
若实验中大约要使用230mL KOH溶液,至少需要称量KOH固体g.
-
(2) Ⅱ、测定稀硫酸与氢氧化钾溶液反应的中和热:
实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、量筒、环形玻璃搅拌棒,尚缺少的玻璃仪器是.
取50mL KOH溶液和30mL硫酸溶液进行实验,实验数据如表:
①请填写表中的空白:
项目
数据
次数
起始温度T1/℃
终止温度T2/℃
温度差平均值
(T2﹣T1)/℃
H2SO4
KOH
平均值
1
26.2
26.0
26.1
30.1
2
25.9
25.9
25.9
29.8
3
26.4
26.2
26.3
30.4
②近似认为0.50mol/L KOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容为c=4.18J/(g•℃),则中和热△H=.
③某同学进行该实验时未找到环形玻璃搅拌棒,实验中他用铜丝代替环形玻璃棒进行搅拌,测得的中和热的数值会(填“偏大”“偏小”或“无影响”),原因是:.
-
(3) Ⅲ、某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
实验编号
反应物
催化剂
①
10 mL 2% H2O2溶液
无
②
10 mL 5% H2O2溶液
无
③
10 mL 5% H2O2溶液
1 mL 0.1 mol•L﹣1 X溶液
④
10 mL 5% H2O2溶液+少量HCl溶液
1 mL 0.1 mol•L﹣1 X溶液
⑤
10 mL 5% H2O2溶液+少量NaOH溶液
1 mL 0.1 mol•L﹣1 X溶液
1)实验①和②的目的是.
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是(填一种即可).
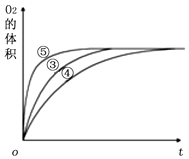
2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示.分析该图能够得出的实验结论是.
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=.
Ⅰ.配制0.50mol/L NaOH溶液
-
(1) 若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体g.
-
(2) 从图中选择称量NaOH固体所需要的仪器是(填字母):.
名称
托盘天平(带砝码)
小烧杯
坩埚钳
玻璃棒
药匙
量筒
仪器

序号
a
b
c
d
e
f
-
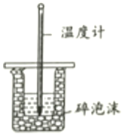
(3) Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.

写出该反应的热化学方程式(中和热为57.3kJ/mol):.
-
(4) 取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度
实验次数
起始温度t1/℃
终止温度
t2/℃
温度差平均值
(t2﹣t1)/℃
H2SO4
NaOH
平均值
①
26.2
26.0
26.1
30.1
②
27.0
27.4
27.2
33.3
③
25.9
25.9
25.9
29.8
④
26.4
26.2
26.3
30.4
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
-
(1) 不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是。
-
(2) 在操作正确的前提下,提高中和热制定准确性的关键是.
-
(3) 根据上表中所测数据进行计算,则该实验测得的中和热△H=[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g.℃)计算].
-
(4) 如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将(填“偏大”、“偏小”、“不变”).如改用60 mL0.5moI/L的盐酸与50 mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”)。
-
(5) 若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是______________。A . 测量盐酸的温度后,温度计没有用水冲洗干净 B . 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 C . 做本实验的当天室温较高 D . 将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水 E . 在量取盐酸时仰视计数 F . 大烧杯的盖扳中间小孔太大。
-
(6) Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:

已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4 , 为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥。
-
(7) 试验编号②和③探究的内容是。
-
(8) 实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时同内平均反应速率v(KMnO4)=mol·L-1·min-1。
-
(1) 在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
实验编号
初始pH
废水样品体积/mL
草酸溶液体积/mL
蒸馏水体积/mL
①
4
60
10
30
②
5
60
10
30
③
5
60
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。

-
(2) 上述反应后草酸被氧化为(填化学式)。
-
(3) 实验①和②的结果表明;实验①中0~t1时间段反应速率v(Cr3+)=mol·L-1·min-1(用代数式表示)。
-
(4) 该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:;
假设三:;
-
(5) 请你设计实验验证上述假设一,完成下表中内容。[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72-的浓度可用仪器测定]
实验方案(不要求写具体操作过程)
预期实验结果和结论
-
(6) 某化学兴趣小组要完成中和热的测定,实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是、。
-
(7) 他们记录的实验数据如下:
实验用品
溶液温度
中和热
t1
t2
ΔH
①
50 mL
0.55 mol·L-1
NaOH溶液
50 mL
0.5 mol·L-1
HCl溶液
20 ℃
23.3 ℃
②
50 mL
0.55 mol·L-1
NaOH溶液
50 mL
0.5 mol·L-1
HCl溶液
20 ℃
23.5 ℃
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1 , 各物质的密度均为1 g·cm-3。计算完成上表中的ΔH。
-
(8) 若用KOH代替NaOH,对测定结果(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果ΔH(填“偏大”或“偏小”无影响)。
-
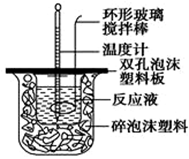
(1) 烧杯间填满碎泡沫塑料的作用是
-
(2) 环形玻璃搅拌棒能否用环形铁质搅拌棒代替?(填“能”或“不能”), 其原因是。
-
(3) 实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是。
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量(填“相等”“不相等”),若实验操作均正确,则所求中和热(填“相等”“不相等”)。
-
(4) 已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:。
-
(1) 实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol/L盐酸、0.55 mol/L NaOH溶液,实验尚缺少的玻璃用品是、。
-
(2) 实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是。
-
(3) 他们记录的实验数据如表:
实验用品
溶液温度
中和热
t1
t2
ΔH
①
50 mL
0.55 mol/L
NaOH溶液
50 mL
0.5 mol/L
HCl溶液
20 ℃
23.3 ℃
②
50 mL
0.55 mol/L
NaOH溶液
50 mL
0.5 mol/L
HCl溶液
20 ℃
23.5 ℃
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ/(℃·kg),各物质的密度均为1 g/cm3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:。
-
(4) 若用KOH代替NaOH,对测定结果
(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果(填“有”或“无”)影响。
-
(1) 写出该反应的热化学方程式[生成1 molH2O(l)时的反应热为-57.3 kJ·mol-1]:。
-
(2) 取50 mLNaOH溶液和30 mL 硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
温度
次数
起始温度t1/℃
终止温度t2/℃
温度差平均值(t2-t1)/℃
H2SO4
NaOH
平均值
1
26.2
26.0
26.1
30.1
2
27.0
27.4
27.2
33.3
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸溶液的密度都是1.0g·mL-1 , 中和后生成溶液的比热容c=4.18J/(g·℃)。则生成1 mol H2O(l)时的反应热ΔH=(取小数点后一位)。
③上述实验数值结果与-57.3kJ·mol-1有偏差,产生偏差的原因不可能是(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
-
(1) 用0.1 mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出kJ热量。
-
(2) 如图装置中仪器A的名称是,碎泡沫塑料的作用是;要重复进行三次实验的目的是 。

-
(3) 用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”、“无影响”)。
-
(4) 将V1 mL 1.00 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是_____。
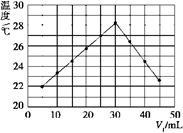 A . 做该实验时环境温度为22 ℃ B . 该实验表明化学能可以转化为热能 C . NaOH溶液的浓度约为1.00 mol·L-1 D . 该实验表明有水生成的反应都是放热反应
A . 做该实验时环境温度为22 ℃ B . 该实验表明化学能可以转化为热能 C . NaOH溶液的浓度约为1.00 mol·L-1 D . 该实验表明有水生成的反应都是放热反应
![]()
-
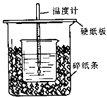
(1) 从实验装置上看,图中缺少的一种玻璃仪器是。
-
(2) 若三次平行操作测得数据中,起始时盐酸与NaOH溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①3.3℃、②3.5℃、③4.5℃,则最终代入计算式的温度差的平均值为℃。
-
(3) 下列对中和反应反应热测定实验的说法错误的是(____________)A . 一组完整实验数据需要测温度3次 B . 量热计中的隔热层可以减少实验过程中的热量散失 C . 可用铜做的搅拌器代替玻璃搅拌器,因铜和盐酸不反应 D . 在量取NaOH溶液和HCl溶液体积时均仰视,测得中和热数值将偏大
-
(4) 用一定浓度的盐酸和NaOH溶液测得中和热数值为ΔH1 , 若将盐酸改为相同体积、相同浓度的醋酸,测得中和热数值为ΔH2 , 则ΔH1与ΔH2的关系为ΔH1(填“<”“>”或“=”)ΔH2 , 理由是。
 溶液分别与
溶液分别与  的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D . 在测定中和热实验中需要使用的仪器有量筒、烧杯、酒精灯、温度计等
的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D . 在测定中和热实验中需要使用的仪器有量筒、烧杯、酒精灯、温度计等
选项 | A | B | C | D |
目的 | 准确量取25.00mLNaOH溶液 | 测定中和热 | 粗铜精炼 | 比较 |
装置或操作 |
|
|
|
|
 (aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO
(aq)+2H+(aq)=H2O(l)+CO2(g) ΔH1<0, HCO (aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题:
(aq)+H+ (aq) =H2O(l) +CO2(g) ΔH2>0。回答下列问题:
-
(1) 乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?(填“甲”或“乙”),理由是。
-
(2) 查阅资料:
反应I :CO
 (aq) +2H+ (aq)=H2O(l) +CO2(g) ΔH1=-12.14kJ·mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) ΔH1=-12.14kJ·mol-1;反应II :HCO
 (aq) +H+ (aq)=H2O(l) +CO2(g) ΔH2= +12.64 kJ·mol-1
(aq) +H+ (aq)=H2O(l) +CO2(g) ΔH2= +12.64 kJ·mol-1①则反应III:CO
 (aq)+ H+ (aq)=HCO
(aq)+ H+ (aq)=HCO (aq) ΔH3= kJ·mol-1。
(aq) ΔH3= kJ·mol-1。②向V mLc mol·L-1碳酸钠溶液中,逐滴加入2V mL c mol·L-1稀盐酸。下列图像中,能正确表示该反应过程中的能量变化的是(填标号)。

-
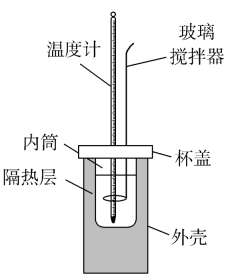
(3) 该化学兴趣小组用如图所示装置设计了实验,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。
表格一:
试剂1
试剂2混合前温度/℃
混合后温度/℃
0.5 g Na2CO3
40mL HCl 19.0
21.7
0.5 g NaHCO3
40 mL HCl 19.0
18.1
表格二:
试剂1
试剂2混合前温度/℃
溶解后温度/℃
静置后的温度/℃
试剂3混合前温度/℃
混合后温度/℃
0.5gNa2CO3
10mLH2O19.0
22.3
19.0
10mLH2O19.0
19.0
0.5gNaHCO3
10mLH2O19.0
17.5
19.0
10mLH2O19.0
19.0
表格三:
试剂1
试剂2混合前温度/℃
溶解后温度/℃
静置后的温度/℃
试剂3混合前温度/℃
混合后温度/℃
0.5gNa2CO3
10mLH2O19.0
22.3
19.0
10mLHCl19.0
20.5
0.5gNaHCO3
10mLH2O19.0
17.5
19.0
10mLHCl19.0
18.3
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是。
②表格二对应实验得出的结论是。
③反应IV:Na2CO3(s)+2H+(aq)=2Na+(aq)+H2O(l)+CO2(g) ΔH4;
反应V:NaHCO3(s)+H+(aq)=Na+(aq)+H2O(l)+CO2(g) ΔH5
则ΔH1(填“>”、“<”或“=”,下同)ΔH4 , ΔH2ΔH5。
 的Ka和
的Ka和 的Ka1大小
的Ka1大小