化学实验方案的评价 知识点题库
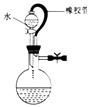 该装置气密性良好
B .
该装置气密性良好
B . 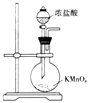 实验室制备氯气
C .
实验室制备氯气
C . 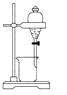 分离酒精和水
D .
分离酒精和水
D .  蒸干NH4Cl溶液制NH4Cl固体
蒸干NH4Cl溶液制NH4Cl固体
 分离乙醇和乙酸
B .
分离乙醇和乙酸
B .  制取乙酸乙酯
C .
制取乙酸乙酯
C . 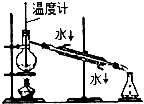 石油的蒸馏
D .
石油的蒸馏
D . 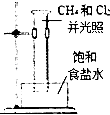 甲烷与氯气反应
甲烷与氯气反应
操作和现象 | 结论 | |
A | 将一小块钠分别投入盛有水和乙醇的小烧杯中,钠与乙醇反应要平缓得多 | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 |
B | 在催化剂存在的条件下,石蜡油加强热生成的气体通入溴的四氯化碳溶液中,溶液褪色 | 石蜡油的分解产物中含有烯烃 |
C | 向盛有Na2CO3固体的锥形瓶中滴加稀盐酸,产生无色气体 | 不能证明氯元素的非金属性强于碳元素 |
D | 向蔗糖溶液中加入稀硫酸,水浴加热一段时间后,再加入新制Cu(OH)2悬浊液,用酒精灯加热,未见砖红色沉淀 | 蔗糖未水解 |
I.NH4+含量的测定
采用蒸馏法,蒸馏装置如图所示.

相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入圆底烧瓶中;
②准确量取50.00mL 3.0300mol•L-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,加热蒸馏;
④用0.120mo l•L-1 NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶.
-
(1) 仪器M的名称为。
-
(2) 步骤③中,发生的氧化还原反应的化学方程式为。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”。“处理”的操作方法是。
-
(3) 步骤④中,若振荡时锥形瓶中有液体溅出,则所侧得的n(NH4+)的值将(填“偏大”、“偏小”或“不变”).
-
(4) Ⅱ.SO42-的测定
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X于烧杯中,加水溶解,边搅拌边加入过量的 BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重.得沉淀质量69.90g.
步骤①中,判断 BaCl2溶液已过量的实验操作和现象是。
-
(5) 步骤②中,采用冷水洗涤沉淀,其主要目的是.
-
(6) 综合实验I、Ⅱ,通过计算得出晶体X的化学式为,实验Ⅰ的步骤①中,溶液中离子浓度由大到小的顺序为。
| 选项 | 方法 | 结论 |
| A. | 同温时,等质量的锌粒分别与足量稀硫酸反应 | 产生氢气量:加胆矾等于没加胆矾 |
| B. | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,则溶液变黄 | 氧化性:H2O2>Fe3+ |
| C. | 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 | 反应速率:粉状大理石>块状大理石 |
| D. | 向2 mL 0.1mol·L-1的Na2S溶液中滴入几滴0.1 mol·L-1的ZnSO4溶液,有白色沉淀生成;再加入几滴0.1 mol·L-1CuSO4溶液,则又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
![]()
已知:①铁和硫反应产物不溶于碱,能溶于硫酸
②硫可溶于热碱溶液,发生类似于 Cl2 和 NaOH 溶液的化学反应下列说法不正确的是( )
 2S2-+SO32-+3H2O
2S2-+SO32-+3H2O
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用 | 前者的试纸颜色比后者深 | 非金属性: |
| B | 向盛有稀 | 试管口出现红棕色气体 | 溶液中的 |
| C | 向两支盛有 | 前者溶液变蓝,后者有黄色沉淀生成 | |
| D | | 红棕色沉淀逐渐转变为白色 | |
|
选项 |
实验操作 |
现象 |
结论 |
|
A |
向NaCl粉末中加入适量酒精,充分振荡形成无色透明液体,用激光笔照射 |
出现一条光亮通路 |
形成的分散系是胶体 |
|
B |
向2支分别盛有5mL0.1mo1∙L-1、1.0mo1.L-1NaHSO3溶液的试管中同时加入2mL5%H2O2溶液 |
均有气泡产生且1.0mo1∙L-1NaHSO3溶液产生气泡快 |
浓度大的NaHSO3溶液反应速率快 |
|
C |
取4mL淀粉溶液,加入5mL稀硫酸,加热5min后,再加入少量新制的Cu(OH)2 , 加热至沸腾 |
没有出现砖红色沉淀 |
淀粉未水解 |
|
D |
将Mg片和AL片用导线相连后,同时插入NaOH溶液中 |
Mg片上产生气泡 |
Al的金属性比Mg强 |
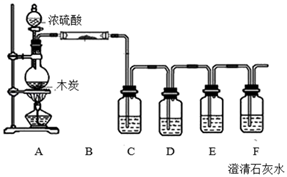
-
(1) 写出A中木炭与浓硫酸反应的化学方程式。
-
(2) B中盛放的试剂X为,现象变化为。
-
(3) C中盛放溶液,先检验气体。
-
(4) D中可以盛放的试剂是。
①NaOH溶液 ②饱和NaHCO3溶液 ③酸性高锰酸钾溶液 ④饱和NaHSO3溶液
-
(5) 若要证明木炭与浓硫酸反应产生了CO2气体,可依据的实验现象是。

下列说法错误的是( )
 =CO
=CO  +H2O
C . “过滤”所需玻璃仪器:普通漏斗、烧杯、玻璃棒
D . Na2CO3、CO2可在流程中循环利用
+H2O
C . “过滤”所需玻璃仪器:普通漏斗、烧杯、玻璃棒
D . Na2CO3、CO2可在流程中循环利用

-
(1) 仪器a的名称是;实验前,第一步操作是。
-
(2) 在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是。
-
(3) 如表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是。
方案
反应物
甲
Cu、浓HNO3
乙
Cu、稀HNO3
丙
Cu、O2、稀HNO3
-
(4) 该装置也可用来证明酸性强弱:如H2CO3>H2SiO3。
方法如下:在a中加入稀硫酸,c中加入的试剂是 (填编号,下同),d中加入的试剂是;如果在d中看到,即可证明酸性:H2CO3>H2SiO3。
供选择的试剂:
A.Na2SiO3溶液 B.稀硫酸 C.NaCl溶液 D.Na2CO3溶液 E.碳酸钙
| 实验 | 现象 | 结论 | |
| A | 向2 mL 0.1FeCl3的溶液中加足量铁粉,震荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D | 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | 溶解度:AgI>AgCl |
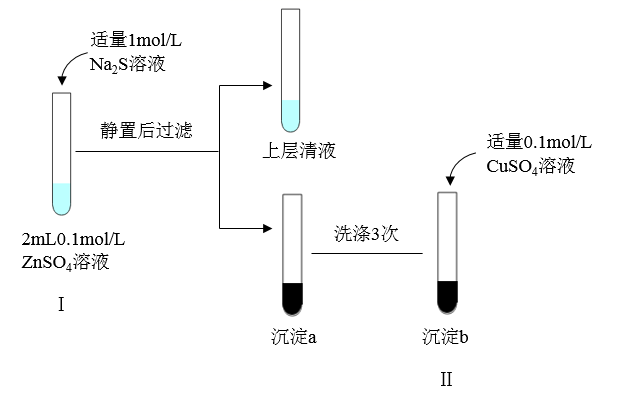
资料:几种难溶电解质的信息
难溶电解质 | 颜色 | Ksp 的数值(18-25℃) |
ZnS | 白色 | 1.6×10-24 |
CuS | 黑色 | 1.3×10-36 |
FeS | 黑色 | 6.3×10-18 |
-
(1) 试管 I 中发生反应的离子方程式是。
-
(2) 试管 II 中观察到白色沉淀转化为黑色沉淀。请结合化学用语,从平衡移动的角度进行解释。
-
(3) 若将沉淀 a 洗涤 3 次后,加适量 0.1mol/LFeSO4 溶液,是否能看到白色沉淀转化为黑色沉淀,请结合计算予以说明。
 可用作杀虫剂,其制备步骤如下。
可用作杀虫剂,其制备步骤如下。步骤1:向足量铜粉与一定量稀 的混合物中通入热空气,当铜粉不再溶解时,过滤得滤液。
的混合物中通入热空气,当铜粉不再溶解时,过滤得滤液。
步骤2:向步骤1所得滤液中边搅拌边滴加氨水,沉淀先增加后减少。当沉淀完全溶解时,停止滴加氨水。
步骤3:向步骤2所得溶液中加入95%乙醇,析出深蓝色 晶体。
晶体。
下列说法正确的是( )
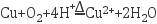 B . 步骤2所得溶液中大量存在的离子有
B . 步骤2所得溶液中大量存在的离子有 、
、 、
、 、
、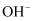 C . 步骤3加入95%乙醇的目的是降低
C . 步骤3加入95%乙醇的目的是降低 的溶解量
D .
的溶解量
D .  中有12个配位键
中有12个配位键
实验操作及现象 | 结论或解释 | |
A | 向Na2SO3溶液中,加入BaCl2溶液,产生白色沉淀,过滤洗涤后,向所得沉淀中加入足量稀硝酸,沉淀不溶解 | Na2SO3溶液已变质 |
B | 向酸性KMnO4溶液中滴加H2O2溶液,紫红色褪去 | H2O2具有还原性 |
C | 向Al2(SO4)3溶液中逐滴加入NaOH溶液至过量,先生成白色沉淀,后沉淀消失 | Al(OH)3具有两性 |
D | 向饱和NaHCO3溶液中滴加饱和CaCl2溶液,既产生白色沉淀又生成无色气体 | Ca2++2HCO |
 试纸测定
试纸测定 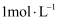 的
的  和
和  溶液的
溶液的 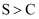
 溶液的试管中加入
溶液的试管中加入  的
的  溶液
溶液 被
被  还原为
还原为 
 溶液的试管中分别滴加淀粉溶液和
溶液的试管中分别滴加淀粉溶液和  溶液
溶液
 溶液中滴入
溶液中滴入  产生,再滴加
产生,再滴加  的
的  溶液
溶液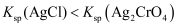

 CaCO3+H2CO3 , 随Ca2+浓度增加,平衡向右移动
CaCO3+H2CO3 , 随Ca2+浓度增加,平衡向右移动


