化学实验方案的评价 知识点题库
A.中和滴定实验时,用待测液润洗锥形瓶
B.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
C.在50mL量筒中配制0.1 000mol•L﹣1碳酸钠溶液
D.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
E.金属钠着火时,用细沙覆盖灭火.
叙述I | 叙述II |
A水玻璃具有黏性 | 盛装烧碱溶液的试剂瓶不能用玻璃塞 |
B往氯化钙溶液中通入足量的CO2 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
C NH4Cl受热易分解 | 可用加热法除去I2中的NH4Cl |
D利用丁达尔现象区分氢氧化铁胶体和浓的氯化铁溶液 | 往氢氧化钠溶液中滴加饱和氯化铁溶液,加热至红褐色制得胶体 |
实验 | 现象 | 结论 | |
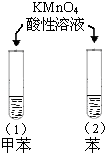
A |
| 试管(1)中紫色消失,试管(2)中紫色没有消失 | 甲苯中苯环使甲基的活性增强 |
B |
| 试管内壁有银镜生成 | X具有还原性,一定含有醛基 |
C |
| 先生成白色沉淀,滴加FeCl3溶液后,生成红褐色沉淀 | Fe(OH)3是比Mg(OH)2更难溶的电解质 |
D |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
-
(1) Cu2+基态核外电子排布式为,S、O、N三种元素的第一电离能由大到小为。
-
(2) SO42-的立体构型是,与SO42-互为等电子体的一种分子为(填化学式)。
-
(3) 往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为。
-
(4) 利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示,其中O2-的配位数是。
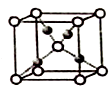
-
(5) B.[实验化学]
实验室以苯甲醛为原料制备间溴苯甲醛 (实验装置见图,相关物质的沸点见附表)。其实验步骤为:

步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
实验装置中冷凝管的主要作用是,锥形瓶中的溶液应为。
-
(6) 步骤1所加入的物质中,有一种物质是催化剂,其化学式为。
-
(7) 步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的(填化学式)。
-
(8) 步骤3中加入无水MgSO4固体的作用是。
-
(9) 步骤4中采用减压蒸馏技术,是为了防止。
附表 相关物质的沸点(101kPa)
物质
沸点/℃
物质
沸点/℃
溴
58.8
1,2-二氯乙烷
83.5
苯甲醛
179
间溴苯甲醛
229
 B . 检验FeCl3溶液中是否混有Fe2+
B . 检验FeCl3溶液中是否混有Fe2+ C . 检验亚硫酸钠溶液是否变质
C . 检验亚硫酸钠溶液是否变质  D . 验证钢铁的析氢腐蚀
D . 验证钢铁的析氢腐蚀 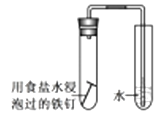
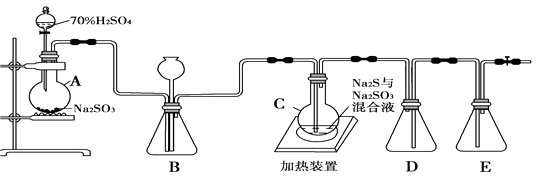
-
(1) 实验一.制备Na2S2O3·5H2O
通过查阅资料,该化学兴趣小组设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体。
已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l) ; S(s)+Na2SO3(aq)
 Na2S2O3(aq)
Na2S2O3(aq)写出A中的化学反应方程式。
-
(2) 装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有(写一条)
-
(3) 装置E的作用是。
-
(4) 为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为。
-
(5) 实验二.性质探究
常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是。
-
(6) 向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子化学方程式。
-
(7) 实验三.Na2S2O3的应用
用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.0100 mol·L-1的Na2S2O3标准溶液进行滴定,反应完全时,相关数据记录如下表所示:
滴定次数
1
2
3
4
消耗Na2S2O3标准溶液的体积/mL
18.02
20.03
17.98
18.00
部分反应的离子方程式为:① Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O
② I2+2S2O32-=S4O62-+2I-
滴定时Na2S2O3标准溶液应该用(填仪器名称) 盛装,该废水中Ba2+的物质的量浓度为。
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向苯酚浊液中加入Na2CO3溶液,溶液变澄清 | 酸性:苯酚>HCO |
| B | 用pH计测定等浓度的Na2CO3和NaClO溶液的pH | 后者pH比前者的大 |
| C | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
| D | 在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
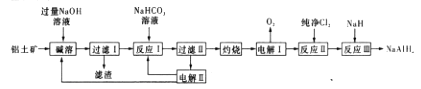
注:SiO2在“碱溶”时转化为铝硅酸钠(Na2Al2SixO8)沉淀。
-
(1) 铝硅酸钠(Na2 Al2SixO4)可以用氧化物的形式表示其组成,形式为。
-
(2) “过滤I”中滤渣的主要成分有(填名称)。向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,发生反应的离子方程式为OH-+HCO3—=CO32—+H2O、。
-
(3) “电解I”的另一产物在1000℃时可与N2反应制备AIN,在这种产物中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是。
-
(4) “电解Ⅱ”是电解Na2CO3溶液,其原理如图所示。

阳极的电极反应式为。已知F=96500C/mol,当I=0.5A时,通电80min,理论上阴极获得H2(标准状况下)的体积为L(结果保留两位有效数字)。
-
(5) 铝氢化钠遇水发生剧烈反应,且反应产生大量气泡,其反应的化学方程式为。
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeBr2溶液中加入少量氯水,再加CCl4振荡 | CCl4层无色 | Fe2+的还原性强于Br- |
| B | 向盐酸中滴入少量NaAlO2溶液 | 无明显现象 | AlO2-与H+未发生反应 |
| C | 向某溶液里滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色无明显变化 | 原溶液中无NH4+ |
| D | 向某溶液中滴加KSCN溶液 | 溶液未变血红色 | 溶液中不含铁元素 |
-
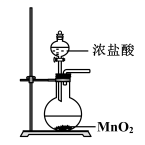
(1) Ⅰ.实验室常用MnO2 与浓盐酸反应制备Cl2(装置如图所示)。
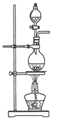
制备实验开始时,先检査装置气密性,接下来的操作依次是:(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
-
(2) 写出圆底烧瓶中发生反应的离子方程式。
-
(3) 制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法(填编号)。
a.将Cl-转化为AgCl沉淀,过滤,洗涤,干燥,称量沉淀的质量
b.与足量NaHCO3固体反应,将反应后气体直接用碱石灰吸收,测定生成的气体的质量
c.与足量锌反应,测量生成气体标准状况下的体积
-
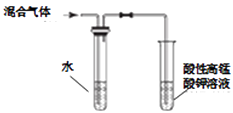
(4) Ⅱ. 为测定某亚硫酸钠样品纯度,研究小组利用如下装置(装置图中夹持仪器已省略)进行实验。反应完全后,取C中溶液,加入过量BaCl2溶液,过滤、操作①、干燥、称量,利用所得数据计算样品纯度。请回答:
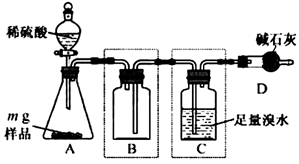
操作①的名称是。
-
(5) 装置B的作用是。
-
(6) 上述实验测得的样品纯度比实际偏低,为提高测定结果的准确度,针对装置可采取的改进措施是(写两种)。
| 选项 | 主要仪器 | 试剂 | 实验目的 |
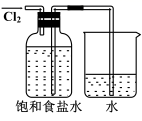
| A | 烧瓶、长颈漏斗、酒精灯、导管 | 软锰矿与浓盐酸 | 制取并收集干燥的氯气 |
| B | 酒精灯、玻璃棒、蒸发皿、三脚架 | | 蒸发溶液得到晶体 |
| C | 圆底烧瓶、导气管、烧杯、铁架台 | 干燥的氨气、水 | 模拟喷泉实验 |
| D | 铁丝、蓝色钴玻璃、酒精灯 | 盐酸、待测液 | 焰色反应实验 |
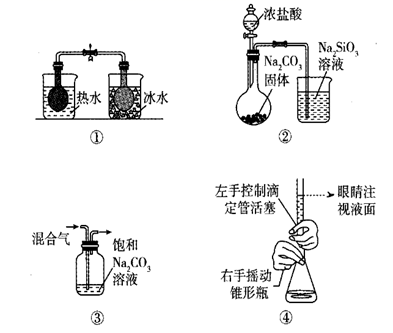
 N2O4(g)的影响
B . ②探究C和Si非金属性的强弱
C . ③除去CO2气体中混有的HCl
D . ④用高锰酸钾标准液滴定市场上的双氧水溶液
N2O4(g)的影响
B . ②探究C和Si非金属性的强弱
C . ③除去CO2气体中混有的HCl
D . ④用高锰酸钾标准液滴定市场上的双氧水溶液
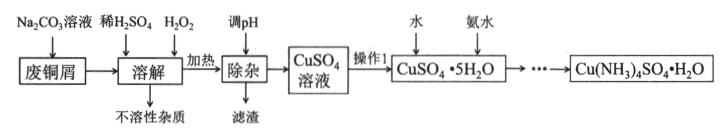
-
(1) 用
 溶液洗涤废铜屑的目的是,之后用水洗涤除去多余的碳酸钠。
溶液洗涤废铜屑的目的是,之后用水洗涤除去多余的碳酸钠。
-
(2) 将稀硫酸加入到废铜屑中无反应发生,再加入适量
 , 可生成硫酸铜,写出该反应的化学方程式;此反应采取加热的方法来加快化学反应速率,同时加热温度不宜过高的原因是:;若将稀硝酸和稀硫酸以2∶3的比例加入废铜屑中,也可得到硫酸铜:
, 可生成硫酸铜,写出该反应的化学方程式;此反应采取加热的方法来加快化学反应速率,同时加热温度不宜过高的原因是:;若将稀硝酸和稀硫酸以2∶3的比例加入废铜屑中,也可得到硫酸铜: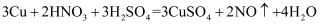 , 指出该方案的主要缺点是。
, 指出该方案的主要缺点是。
-
(3) 可以加入CuO来调pH值除杂,使
 转化为
转化为 , 沉淀而除去,请结合平衡移动原理分析加入CuO除杂的原因。(写出相关的离子方程式并辅以必要的文字说明)
, 沉淀而除去,请结合平衡移动原理分析加入CuO除杂的原因。(写出相关的离子方程式并辅以必要的文字说明)
-
(4) 操作1的步骤为:蒸发浓缩、、过滤、冰水洗涤、干燥。冰水洗涤的目的是:洗去晶体表面的杂质、。
-
(5) 测定产品中
 的质量分数的步骤如下:准确称取0.492g产品于锥形瓶中,加
的质量分数的步骤如下:准确称取0.492g产品于锥形瓶中,加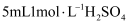 溶液和100mL水使其溶解,加入10mL10%KI溶液(
溶液和100mL水使其溶解,加入10mL10%KI溶液(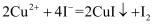 ),加入淀粉作指示剂,用
),加入淀粉作指示剂,用 溶液滴定至浅蓝色(
溶液滴定至浅蓝色(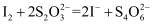 ),再加入10%KSCN溶液10mL,摇匀后,溶液蓝色加深,再继续用
),再加入10%KSCN溶液10mL,摇匀后,溶液蓝色加深,再继续用 溶液滴定至蓝色刚好消失,共消耗
溶液滴定至蓝色刚好消失,共消耗 溶液19.20mL。
溶液19.20mL。①加10%KSCN溶液将CuI转化为CuSCN,其离子方程式为:
 , 求该反应的平衡常数K=。[已知:
, 求该反应的平衡常数K=。[已知: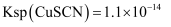 ,
, 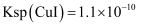 ]
]②计算产品中
 的质量分数为(列出计算式即可)。
的质量分数为(列出计算式即可)。
选项 | 实验操作 | 实验现象 | 结论 |
A | 向1mL1%的NaOH溶液中加入2mL2%的 | 未出现砖红色沉淀 | X结构中不含有醛基 |
B | 将乙醇和浓硫酸共热至170℃后,将生成的气体通入酸性 |
| 证明乙烯能使 |
C | 卤乙烷与NaOH溶液加热至不再分层,冷却后加稀硝酸至酸性,再滴加 | 淡黄色沉淀产生 | 卤素原子为溴原子 |
D | 向苯酚浓溶液中滴入溴水,振荡 | 无白色沉淀产生 | 苯酚与溴水不反应 |
-
(1) I.确定该蛋白质中的某些组成元素
为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是。
-
(2) 为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行探究,通入氧气使样品在装置A中 充分燃烧,并使其产物依次缓缓通过其余装置。
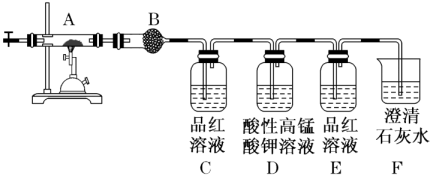
①装置B中的试剂是。
②装置D的作用是。
③当装置B、C、E、F依次出现下列现象:,品红溶液褪色,,出现白色浑浊;可证明燃烧产物中含有H2O,SO2>CO2 , 结论:该蛋白质中含碳、氢、硫、氮等元素。
-
(3) II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫, 再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2
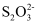 +I2=
+I2=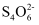 +2I-
+2I-写出二氧化硫与碘水反应的化学方程式:。
-
(4) 滴定终点的现象为。
-
(5) 取蛋白质样品m g进行测定,采用c1 mol·L-1的碘水V1 mL进行吸收,滴定过量的碘样时消耗c2 mol·L-1硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为。
-
(6) 若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值(填“偏大*偏小”或“无影响”)。
 原理和
原理和 的资源化利用,过程如下。
的资源化利用,过程如下。
-
(1) 配制模拟酸洗废液。配制
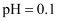 的
的 和
和 混合溶液,向其中加入计算量的
混合溶液,向其中加入计算量的 , 得到
, 得到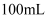 含铬量为
含铬量为 的模拟酸洗废液。
的模拟酸洗废液。 转化为
转化为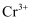 的离子方程式为。
的离子方程式为。
-
(2) 研究除
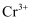 原理。如题图所示,向三颈瓶中加入
原理。如题图所示,向三颈瓶中加入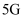 铁粉,在搅拌下加入模拟酸洗废液
铁粉,在搅拌下加入模拟酸洗废液 ,
, 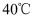 下加热
下加热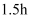 , 产生不溶物,过滤。
, 产生不溶物,过滤。
①采用
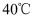 水浴加热的优点为。
水浴加热的优点为。②仪器A的名称是。
③除
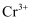 原理推测如下:加入铁粉与溶液中的
原理推测如下:加入铁粉与溶液中的 反应,溶液中的
反应,溶液中的 和
和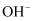 含量升高:随着溶液
含量升高:随着溶液 升高,
升高, 更易与
更易与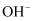 结合生成
结合生成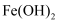 ;
;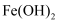 进一步氧化生成
进一步氧化生成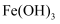 胶体;
胶体;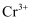 一方面因
一方面因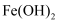 和
和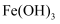 胶体具有的较好吸附性除去,
胶体具有的较好吸附性除去,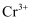 被除去的另一重要原因是。
被除去的另一重要原因是。 -
(3)
 的资源化利用。利用过程(2)中滤液进一步处理后得到的
的资源化利用。利用过程(2)中滤液进一步处理后得到的 溶液,制备电池级
溶液,制备电池级 。
。已知:

请补充实验方案:将
 溶液低温蒸发浓缩,,干燥,得到
溶液低温蒸发浓缩,,干燥,得到 (须选用的试剂:
(须选用的试剂: 溶液、
溶液、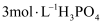 溶液、
溶液、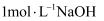 溶液、
溶液、 溶液)。
溶液)。
 溶液,有关实验装置和原理能达到实验目的的是( )
溶液,有关实验装置和原理能达到实验目的的是( )A | B | C | D |
|
|
|
|
制取氯气 | 制取氯水 | 提高 | 分离出 |



 溶液
溶液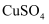 溶液,振荡后再加入0.5mL有机物X,加热煮沸
溶液,振荡后再加入0.5mL有机物X,加热煮沸 溶液中
溶液中 溶液
溶液