化学实验方案的评价 知识点题库
实验操作 | 现象 | 结论 | |
A | 稀硫酸滴入碳酸钠溶液中,将产生的气体通入盛有硅酸钠溶液的烧杯中 | 烧杯中产生白色胶状沉淀 | 非金属性:S>C>Si |
B | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
C | 将饱和氯化铁溶液滴入盛有沸水的烧杯中,继续煮沸至溶液呈红褐色,停止加热,用激光笔照射烧杯中的液体 | 看到一条光亮的“通路” | 证明生成了氢氧化铁沉淀 |
D | 在分液漏斗中加入碘水后再加入CCl4 , 充分振荡、静置 | 分层,且上层溶液呈紫色 | CCl4可作为碘的萃取剂 |

A | B | C | D |
向容量瓶中转移液体 |
实验室制取蒸馏水 |
从饱和食盐水中提取NaCl晶体 |
分离酒精和水 |
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 晶体硅熔点高硬度大 | 可用于制作半导体材料 |
B | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
C | NH4HCO3受热易分解 | 可用作氮肥 |
D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
选项 | 实验操作 | 实验目的 |
A | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化 | 证明二氧化硫具有漂白性 |
B | 向2mL 1mol•L﹣1NaOH溶液中先加入3滴1mol•L﹣1 FeCl3 , 再加入3滴1mol•L﹣1MgCl2溶液 | 证明K[Mg(OH)2]>K[Fe(OH)3] |
C | 相同条件下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液 | 探究Cu2+、Fe3+对H2O2分解速率的影响 |
D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴NaClO的84消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,84消毒液的氧化能力增强 |

| 选项 | 操作 | 现象 | 结论 |
| A | 向某溶液中加入NaOH 溶液,并将红色石蕊试纸置于溶液中 | 试纸变蓝 | 原溶液中有NH4+ |
| B | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| C | 向某溶液中滴加氯水后,再加KSCN溶液 | 溶液变红 | 该溶液中一定有Fe3+ |
| D | 向某无色溶液中滴加BaCl2溶液 | 产生白色沉淀 | 该无色溶液中一定含有SO42- |
 B . 收集H2或CO2
B . 收集H2或CO2  C . 高温煅烧石灰石
C . 高温煅烧石灰石  D . 稀释浓硫酸
D . 稀释浓硫酸 
-
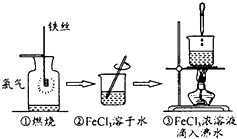
(1) 装置的合理连接顺序为A、、D,其中E装置U形管左边设计为粗导管的目的是。
-
(2) A装置中发生反应的化学方程式为。
-
(3) 反应过程发现,装置B中除生成红棕色固体外,还观察到黄绿色气体,生成该气体的化学方程式为。
-
(4) 待B中充分反应后,停止加热后,还需持续通氧气至。
-
(5) 设计实验:
①利用E装置U形管里的固体验证Fe(OH)3是弱碱:。
②测定装置B的残留固体中铁元素的质量

-
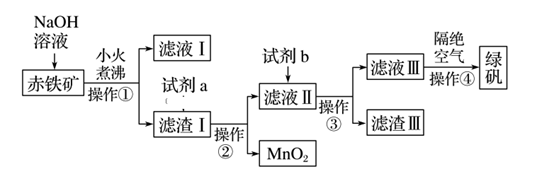
(1) 实验室中操作①的名称为。所需的玻璃仪器有烧杯、、。
-
(2) 氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为。
-
(3) 加入滤渣Ⅰ中的试剂a是,滤液Ⅱ中的主要金属阳离子有。
-
(4) 试剂b为。
-
(5) 滤渣Ⅲ中的主要成分是。操作④隔绝空气的目的是。
| 选项 | 实验 | 现象 | 结论 |
| A | 常温下,测定饱和CH3COONa和NaNO2溶液的pH | pH(NaNO2)<pH(CH3COONa) | HNO2酸性大于CH3COOH |
| B | 向含有酚酞的Na2CO3溶液中滴加少量BaCl2固体 | 溶液颜色变浅 | Na2CO3溶液中存在水解平衡 |
| C | 向10 mL 0.1 mol/L AgNO3溶液中滴加2滴0.01 mol/L NaCl,再滴加2滴0.01 mol/ LNaBr溶液 | 先产生白色沉淀,然后产生黄色沉淀 | Ksp(AgCl)>Ksp(AgBr) |
| D | 把固体AgCl加入到较浓的KI溶液 | 白色固体变黄 | AgCl溶解度小于AgI |
 与足量水是否反应完全
C . 加热硫酸铵和熟石灰混合物,判断氨气是否最大量逸出
D . 碳酸钠与盐酸反应时判断盐酸是否足量
与足量水是否反应完全
C . 加热硫酸铵和熟石灰混合物,判断氨气是否最大量逸出
D . 碳酸钠与盐酸反应时判断盐酸是否足量
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaOH | 制氯气并吸收尾气 | |
B | 浓硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸>碳酸>硅酸 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
已知:PCl3、POCl3的部分性质如下:
熔点/℃ | 沸点/℃ | 相对分子质量 | 其它 | |
PCl3 | -112 | 75.5 | 137.5 | 遇水生成H3PO3和HCl |
POCl3 | 2 | 105.3 | 153.5 | 遇水生成H3PO4和HCl |
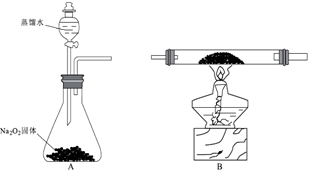
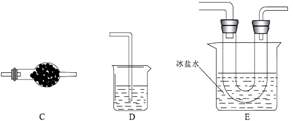
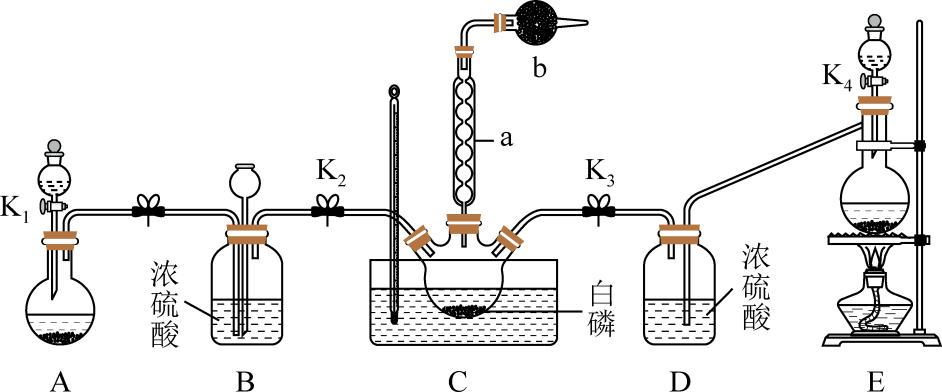
某化学兴趣小组模拟该工艺设计实验装置如图(某些夹持装置和加热装置已略去):
-
(1) 检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器a的名称为,b中盛放的药品是。
-
(2) 装置E反应的离子方程式为。
-
(3) C反应温度控制在60~65℃,不能过高或过低的原因是。分离提纯获得POCl3的实验方法是。
-
(4) 通过测定三氯氧磷产品中氯元素含量,可进一步计算产品的纯度,实验步骤如下:
①取ag产品置于盛50.00mL蒸馏水的水解瓶中,摇动至完全水解,将水解液配成100.00mL溶液,预处理排除含磷粒子的影响。
②取10.00mL溶液于锥形瓶中,向其中加入Comol/L-1的AgNO3溶液V0mL,使Cl-完全沉淀,再加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后选择Fe(NO3),指示剂,用c1mol/L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为V1mL。
[已知:Ksp(AgCl)=3.2×10-10 , Ksp(AgSCN)=2.0×10-12]
滴定终点的现象:。实验过程中加入硝基苯的目的是,若无此操作,则所测POCI3的含量将(填“偏高”“偏低”或“不变”)。
-
(5) 产品中POCl3的质量分数为。
选项 | 实验操作 | 实验现象 | 结论 |
A | 向溶液X中先滴加稀硝酸,再滴加 | 出现白色沉淀 | 溶液X中一定含有 |
B |
| 溶液褪色 |
|
C | 将铜片与稀硝酸混合 | 试管口有红棕色气体 | 铜片与稀硝酸反应产生 |
D | Al和浓硫酸在常温下混合 | Al片完全溶解 | 常温下Al被浓硫酸完全溶解 |
选项 | 实验内容 | 实验结论 |
A | 将Fe(NO3)2样品溶于H2SO4后,加入KSCN,溶液显红色 | Fe(NO3)2已经氧化变质 |
B | 取1 mL0.1 mol/L KI溶液于试管中,加入5 mL0.1 mol/LFeCl3 , 充分反应后滴入5滴15%KSCN溶液 | 若溶液变血红色,则KI和FeCl3反应有一定限度 |
C | 向2支盛有5 mL不同浓度NaHSO3溶液的试管中,同时加入2 mL 5% H2O2溶液,观察并比较实验现象 | 探究浓度对反应速率的影响 |
D | 用pH试纸测定NaCl和NaF溶液的pH,pH(NaCl)<pH(NaF) | 结合H+能力:Cl-<F- |
 排放,往往会产生污染。某研究性小组探究NO与炽热的铜粉反应,设计如下实验
排放,往往会产生污染。某研究性小组探究NO与炽热的铜粉反应,设计如下实验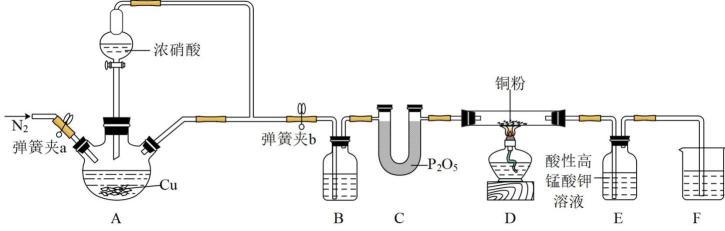
已知:NO能被酸性高锰酸钾溶液氧化成 , E中产生的
, E中产生的 浓度较稀。
浓度较稀。
下列说法错误的是( )
 , 排尽空气,防止空气中氧气干扰实验,实验后通
, 排尽空气,防止空气中氧气干扰实验,实验后通 , 排尽装置内的NO,防止拆卸时产生污染性气体
B . 装置B中的试剂为
, 排尽装置内的NO,防止拆卸时产生污染性气体
B . 装置B中的试剂为 C . 反应一段时间后,装置D中铜粉变黑,D中发生反应的化学方程式
C . 反应一段时间后,装置D中铜粉变黑,D中发生反应的化学方程式 D . F装置中的试剂是NaOH,吸收多余的NO,防止污染环境
D . F装置中的试剂是NaOH,吸收多余的NO,防止污染环境
 、
、 、
、 B .
B .  饱和溶液中加浓盐酸会析出晶体
C . 可用碘水检验淀粉是否水解完全
D . 用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
饱和溶液中加浓盐酸会析出晶体
C . 可用碘水检验淀粉是否水解完全
D . 用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质


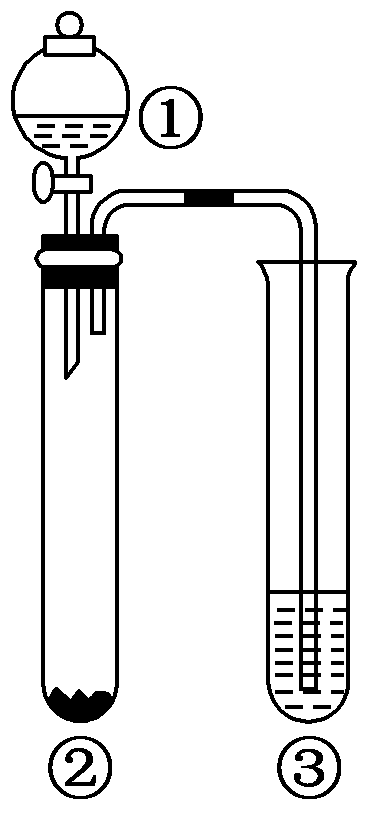
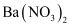 溶液
溶液
 通入酸性
通入酸性 溶液中
溶液中



