化学实验方案的评价 知识点题库
 制取氨气
B .
制取氨气
B . 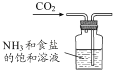 制取NaHCO3
C .
制取NaHCO3
C .  分离NaHCO3
D .
分离NaHCO3
D .  干燥NaHCO3
干燥NaHCO3
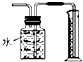 用如图所示装置测量Cu与浓硝酸反应生成气体的体积
C .
用如图所示装置测量Cu与浓硝酸反应生成气体的体积
C . 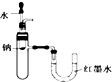 用如图所示装置验证Na和水反应的热效应
D .
用如图所示装置验证Na和水反应的热效应
D . 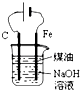 用如图装置制备Fe(OH)2并能较长时间观察其颜色
用如图装置制备Fe(OH)2并能较长时间观察其颜色
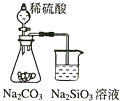 证明元素非金属性强弱 S>C>Si
B .
证明元素非金属性强弱 S>C>Si
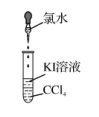
B .  四氯化碳萃取碘水中的碘
C .
四氯化碳萃取碘水中的碘
C .  制备并收集少量NO气体
D .
制备并收集少量NO气体
D . 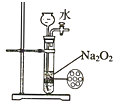 制备少量氧气
制备少量氧气
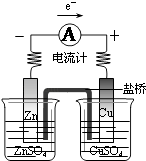 探究原电池原理
B .
探究原电池原理
B .  制备无水氯化铁
C .
制备无水氯化铁
C . 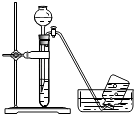 探究铁与水反应
D .
探究铁与水反应
D .  收集氨气
收集氨气
A | B | C | D |
|
|
|
|
用酒精萃取碘水中的碘 | 烧杯中的Fe(OH)3胶体可产生丁达尔效应 | 蔗糖遇浓硫酸变黑,说明浓硫酸有脱水性 | Fe(OH)2白色沉淀迅速变成灰绿色,最后变成红褐色,说明Fe(OH)2易被氧化 |
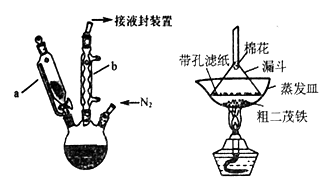
①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a 中加入60mL 无水乙醚到三颈烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a 滴入5.5 mL 新蒸馏的环戊二烯(C5H6、密度0.95g/cm3),搅拌;
③将6.5g 无水FeCl2 与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25ml 装入仪器a中,慢慢滴入三颈烧瓶中,45min 滴完,继续搅拌45min;
④再从仪器a 加入25mL 无水乙醚搅拌;
⑤将三颈烧瓶中液体转入分液漏斗,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
-
(1) 仪器b 的名称是,作用是。
-
(2) 步骤①中通入氮气的目的是。
-
(3) 三颈烧瓶的适宜容积应为 (填序号);①100ml、②250ml、③500ml;步骤⑤所得的橙黄色溶液的溶剂是。
-
(4) KOH、FeCl2、C5H 6反应生成二茂铁[Fe(C5H5)2]和KCl 的化学方程式为。
-
(5) 二茂铁粗产品的提纯过程在上图中进行,其操作名称为。二茂铁及其衍生物可做抗震剂用于制无铅汽油,它们比曾经使用过的四乙基铅安全得多,其中一个重要的原因是。
-
(6) 最终得到纯净的二茂铁4.8g,则该实验的产率为(保留两位有效数字)。
| 实验操作及现象 | 实验结论 | |
| A | 向2mL5%的双氧水中分别滴加2滴0.1mol/L的Fe2(SO4)3和0.1mol/L的CuSO4溶液,前者产生气泡较快 | 对双氧水分解催化效率:Fe3+>Cu2+ |
| B | 向2mL0.1mol/L酸性KMnO4溶液中分别滴加3mL0.1mol/L和3mL0.2mol/L的H2C2O4溶液,后者首先褪色(提示:反应的部分关系为2MnO4-+5H2C2O4—2Mn2++10CO2) | 其他条件不变时,H2C2O4的浓度越大,化学反应速率越快 |
| C | 取两支试管a和b,各加入5ml0.1mol/LNa2S2O3溶液;另取两支试管c和d,各加入5ml0.1mol/LH2SO4溶液;将a、d放入热水浴中, B、c放入冷水浴中,一段时间后分别混合,热水浴中先出现浑浊。(S2O32-+2H+=SO2↑+S↓+H2O) | 温度越高,反应速率越快 |
| D | 用3mL稀H2SO4溶液与足量Zn反应,当气泡稀少时,加入1mL浓H2SO4 , 又迅速产生较多气泡 | H2SO4浓度增大,反应速率加快 |

关于此实验的“现象”“解释或结论”以及对应关系均正确的是( )
| 选项 | 现象 | 解释或结论 |
| A | a处黄色褪去 | 非金属性:Br>S |
| B | b处变为红色 | 二氧化硫与水反应生成酸性物质 |
| C | c处变为蓝色 | 二氧化硫具有一定的氧化性 |
| D | d处红色先褪去后恢复 | 二氧化硫具有漂白性且漂白性不稳定 |
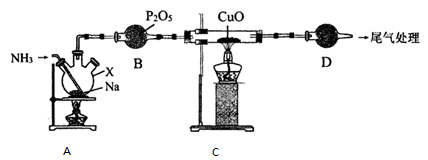
已知:NaNH2极易水解且易被空气氧化。回答下列问题 :
-
(1) 仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是________(填字母序号)。A . 浓氨水、CaO B . NH4Cl固体、Ca(OH)2固体 C . 浓氨水 D . NH4NO3固体 、NaOH固体
-
(2) 仪器D名称为,其中盛放的试剂为 。
-
(3) 装置A中发生反应的化学方程式为 ,能证明装置A中已发生反应的实验依据是。
-
(4) 装置B的作用是。
-
(5) 制备时,通入的氨气过量,待钠充分反应后,取 mg 产品, 按如图装置进行实验(产品所含杂质仅为 Na2O )。
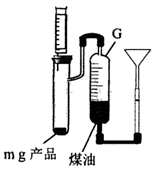
用注射器向试管中缓慢加入H2O至恰好完全反应立即停止,G中液面从刻度V1变 为 V2(已知V2>Vi,单位 mL,忽略固体体积,读取刻度时保持两使液面相平,实验过程处于标准状况下),则产品纯度为:若读取V1时,G中液面低于漏斗侧液面,则所测得的纯度比实际产品纯度(填“偏高”、“ 偏低”或“无影响”)。
| 选项 | 实验操作和现象 | 结论 |
| A | 白铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后滴加几滴 | 该过程未发生氧化还原反应 |
| B | 在各盛5mL 1mol/L NaOH溶液的两支试管中,分别滴入5滴1mol/L | |
| C | 配制 | 抑制 |
| D | 向酸性含碘废水中加入淀粉溶液,然后滴入少量 | 该废水中可能含 |
|
实验目的 |
实验方案 |
|
|
A |
制备CuSO4 |
用稀硫酸、过氧化氢和铜粉反应 |
|
B |
加快酸性KMnO4与H2C2O4溶液的反应速率 |
加入一粒黄豆大的MnSO4固体 |
|
C |
除去NaCl固体表面的少量KCl杂质 |
用饱和NaCl溶液洗涤 |
|
D |
探究浓度对反应速率的影响 |
向盛有同体积、不同浓度NaHSO3溶液的试管中同时加入同体积、同浓度NaClO溶液,观察现象 |
A | B | C | D | |
实验 |
|
|
|
|
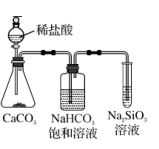
结论 | 吸收氯化氢 | 该装置可用于收集H2 | 检验碘离子 | 证明酸性强弱顺序为: HCl>H2CO3>H2SiO3 |
-
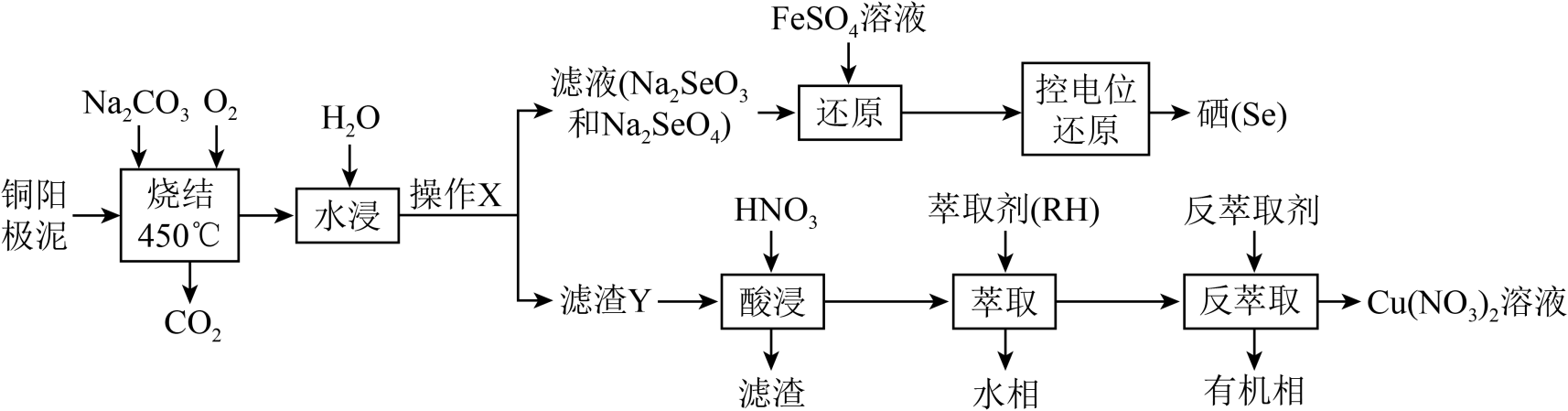
(1) “烧结”时发生如下反应,请完善该反应方程式:。
 _
_ _
_ _
_ _
_ _
_
工业上,采用通入高压氧气使铜阳极泥处于“沸腾”状态,其目的是。
-
(2) 在实验室,操作X的名称为。
-
(3) 滤渣Y的成分有Ag2O、(填化学式,下同);已知萃取与反萃取原理为:2RH+Cu2+→R2Cu+2H+ , 则“反萃取”时反萃取剂最好选用溶液。
-
(4) FeSO4的作用是“还原”Na2SeO4制备Na2SeO3 , 每摩尔Na2SeO4消耗FeSO4的物质的量为mol;常温下,H2SeO3的Ka1=1.0x10-3 , Ka2=1.0x10-7;当常温下溶液的pH=4.4时,Na2SeO3溶液中最主要的含Se粒子是。
-
(5) “控电位还原”是指在一定电压下,电位高的氧化剂优先被还原,电位低的氧化剂保留在溶液中,以达到硒与杂质金属的分离;下表为一些氧化剂的电位(A/B:A代表氧化剂,B代表还原产物)。
名称

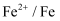
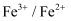

电位/V
0.345
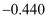
0.770
0.740
则SeO
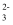 、Fe3+和Cu2+的氧化性由强到弱的顺序为,在0.740V时Fe3+优先被还原,其还原反应(半反应)式为。
、Fe3+和Cu2+的氧化性由强到弱的顺序为,在0.740V时Fe3+优先被还原,其还原反应(半反应)式为。
选项 | 操作 | 现象 | 结论 |
A | 向20%蔗糖溶液中加入少量稀 | 为出现银镜 | 蔗糖未水解 |
B | 测量熔融状态下 | 能导电 | 熔融状态下 |
C | 用石墨作电极电解 | 阴极上先析出铜 | 还原性:Mg>Cu |
D | 向 | 无沉淀生成 |
|

选项 | 实验目的 | 实验操作及现象 |
A | 鉴别乙醇和甲苯 | 取少量两种试剂,分别加入蒸馏水,其中与水互溶不分层的为乙醇,分层的为甲苯 |
B | 证明丙烯醛(CH2=CHCHO)中含有碳碳双键 | 取少量内烯醛,滴加溴水,若溴水褪色,证明含有碳碳双键 |
C | 检验甲酸中混有乙醛 | 取少量试剂,加入氢氧化钠溶液中和甲酸后,加入新制的氢氧化铜,加热,生成砖红色沉淀,说明混有乙醛 |
D | 除去苯中混有的少量苯酚 | 向混合物中滴加饱和溴水,过滤后弃去沉淀 |




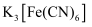
 溶液和1mol/L
溶液和1mol/L 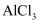 溶液,前者有红褐色沉淀生成,后者无沉淀生成
溶液,前者有红褐色沉淀生成,后者无沉淀生成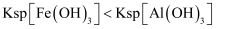
 水解
水解 溶液,废水立刻变蓝色
溶液,废水立刻变蓝色
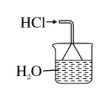

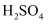 , 加热,一段时间后,再加入银氨溶液
, 加热,一段时间后,再加入银氨溶液 的导电性
的导电性 、
、 、
、
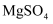 、
、 的混合溶液
的混合溶液 溶液中先通入足量
溶液中先通入足量 , 再通入
, 再通入 气体
气体 不能和
不能和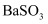 和HCl
和HCl


