化学实验方案的评价 知识点题库
以下物质的制备实验装置正确的是( )
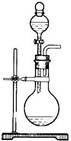


A B C D
 除去CO2中的HCl
B .
除去CO2中的HCl
B . 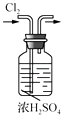 干燥Cl2
C .
干燥Cl2
C .  稀释浓硫酸
D .
稀释浓硫酸
D .  制备少量Cl2
制备少量Cl2
实验目的 | 实验操作 | |
A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
B | 制备Fe(OH)3胶体 | 向沸腾的蒸馏水中逐滴加入少量氯化铁饱和溶液,继续加热煮沸至液体变为红褐色 |
C | 检验溶液中是否含有SO42﹣ | 取少量试液于试管中,先加入BaCl2溶液,再滴加稀盐酸,若产生的白色沉淀不溶解,则说明溶液中含有SO42﹣ |
D | 萃取碘水中的碘 | 将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |
序号 | 实验事实 | 结论 |
A | SO3的水溶液可以导电 | SO3是电解质 |
B | 向某溶液中加入BaCl2溶液和稀HNO3 , 若有白色沉淀生成 | 原溶液中含SO42﹣ |
C | Ca(ClO)2溶液中通入CO2产生白色沉淀 | 酸性:H2CO3>HClO |
D | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
 验证沉淀转化
B .
验证沉淀转化
B . 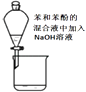 除去苯中的苯酚
C .
除去苯中的苯酚
C .  观察铁的吸氧腐蚀
D .
观察铁的吸氧腐蚀
D .  检验乙炔的还原性
检验乙炔的还原性

-
(1) 电解之前,食盐水需要精制,目的是除去粗盐的中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:①Na2CO3溶液 ②Ba(OH)2溶液 ③稀盐酸。其中合理的加入顺序为 (填序号);
-
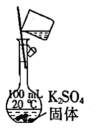
(2) 实验室欲配制6.00 mol/L的食盐水90 mL,回答下列问题:
①需要纯净的NaClg。
②可供选择的仪器有:a玻璃棒 b烧瓶 c烧杯 d胶头滴管 e试管 f托盘天平、砝码 h药匙。在配制食盐水时不需要使用的有(填字母),还缺少的仪器是。
③配制溶液时,一般可以分为以下几个步骤:计算®称量®溶解()转移()定容()装瓶。
④下列操作会使所配溶液的浓度偏小的是。
A. 转移完溶液后未洗涤玻璃棒和烧杯
B. 容量瓶中原来有少量蒸馏水
C. 定容时,俯视刻度线
D. 称量氯化钠固体时左码右物
-
(3) 在电解饱和食盐水过程中,还生成了H2和NaOH,则所发生反应的化学反应方程式为;
-
(4) 将电解生成的Cl2通入NaOH溶液,生成两种盐,其中一种是消毒液的主要成分NaClO,应用氧化还原反应原理,写出此反应的化学方程式是。
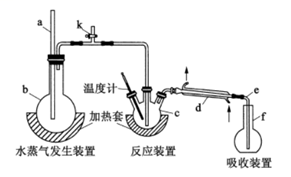
-
(1) a的作用是,仪器d的名称是。
-
(2) 检查装置气密性:在b和f中加水,使水浸没导管a和e末端,,停止加热,导管e内有一段稳定的水柱,说明装置气密性良好。(补全以上操作过程中的空缺内容)
-
(3) c中加入一定体积高氯酸溶液和0.100g氟化稀土样品,f中盛有滴加酚酞的 NaOH溶液。加热
B、c,使b中产生的水蒸气进入c。
①下列物质中可代替高氯酸的是(填序号)。
a.硝酸
b.盐酸
c.硫酸
d.磷酸
②若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是;实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成,但实验结果不受影响,原因是(用化学方程式表示)。
-
(4) 向馏出液中加入25.00mL0.100mol/LLa(NO3)3溶液,得到LaF3沉淀,再用0.100mol/LEDTA标准溶液滴定剩余La3+( La3+与EDTA按1:1结合),消耗EDTA标准溶液22.00mL,则氟化稀土样品中氟元素的质量分数为。
海带  海带灰
海带灰  含有I-的溶液
含有I-的溶液  含有I2的溶液
含有I2的溶液 
 纯净的I2
纯净的I2
请回答下列问题:
-
(1) “灼烧”前先将海带用酒精浸润,其目的是。
-
(2) “过滤”时除了烧杯外还需使用的玻璃仪器有。
-
(3) ①从环保角度考虑,“氧化”时最适合加入的氧化剂是(填标号)。
A.氯气 B.硝酸 C.H2O2
②若使用上述选中的氧化剂在酸性条件下氧化,则发生反应的离子方程式为。
-
(4) 上述流程中涉及的实验操作不包括下列选项中的(填标号)。

-
(5) 请设计一个简单的实验方案,检验加入CCl4萃取碘后的水层中是否还含有碘单质:。
目的 | 方案设计 | 现象和结论 | |
A | 检验某溶液中是否含有 | 取少量该溶液于试管中,加新制氯水,用湿润的碘化钾淀粉试纸检验 | 试纸变蓝色,则该溶液含有 |
B | 探究Mg与Al元素的金属性强弱 | 用pH计测同温同浓度的 |
|
C | 探究苯酚与 | 在苯酚浊液中滴加 | 浊液变澄清,则酸性苯酚> |
D | 检验某溶液中是否含有 | 取少量该溶液于试管中,加少量硫酸酸化的 | 溶液变成绿色,则该溶液中含有 |
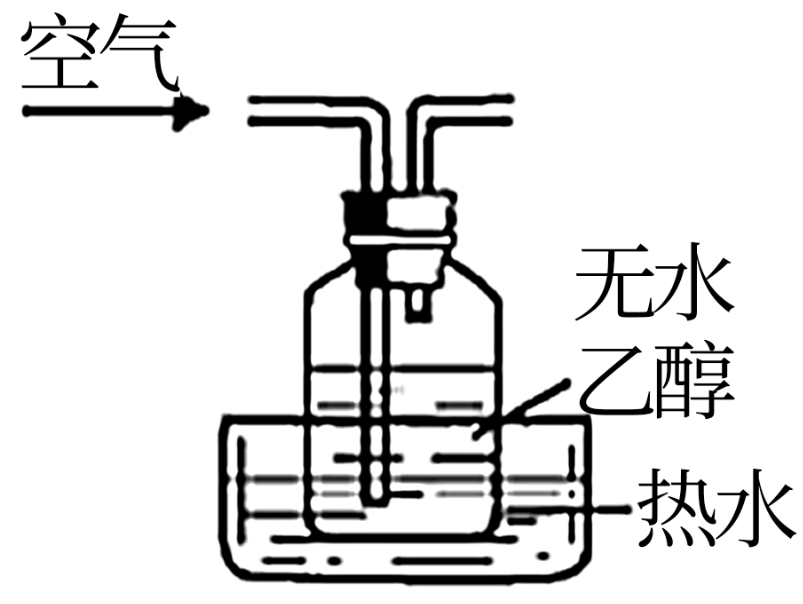 B . 乙醇的催化氧化
B . 乙醇的催化氧化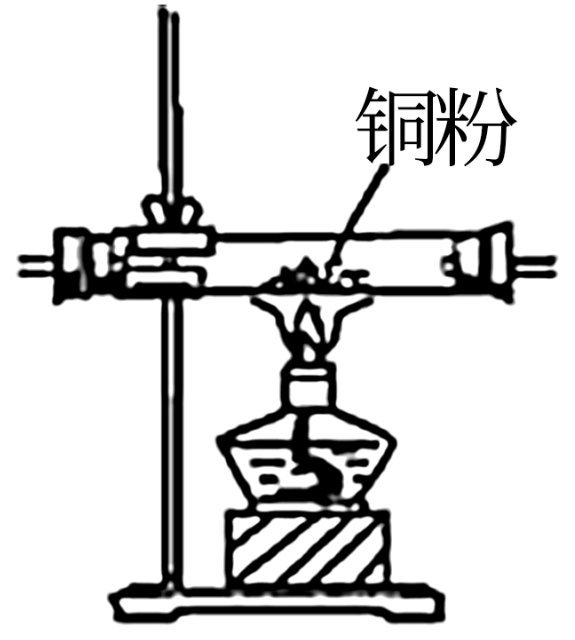 C . 收集产物
C . 收集产物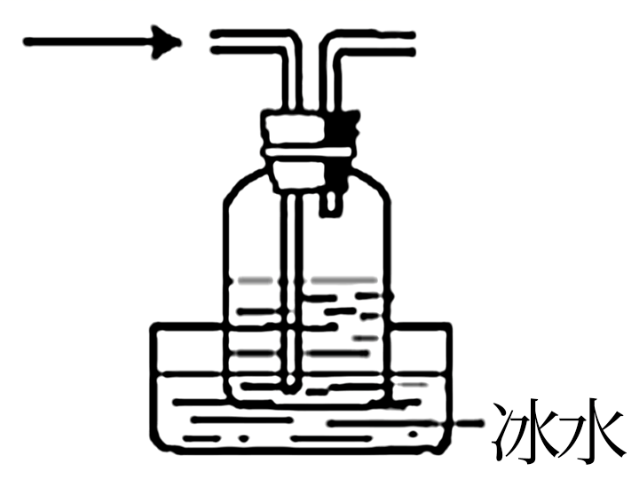 D . 检验乙醛
D . 检验乙醛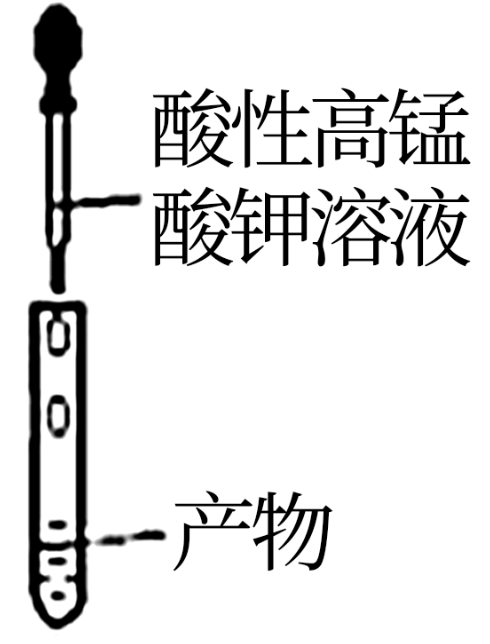
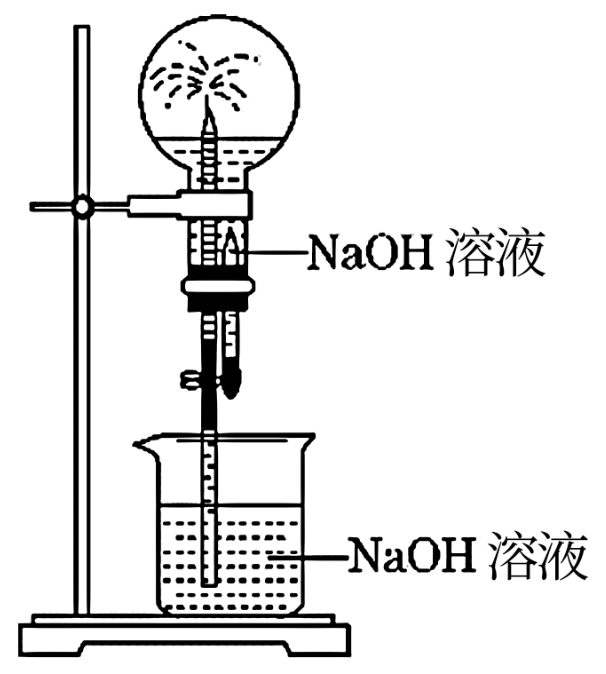
实验目的 | 方案设计 | 现象和结论 | |
A | 探究NO2生成N2O4反应的吸放热 | 将充有NO2的密闭烧瓶放入热水中 | 烧瓶内气体颜色变浅,NO2生成N2O4的反应为吸热反应 |
B | 比较CH3COOH和HF的酸性强弱 | 相同条件下,分别用pH试纸测定0.1mol·L-1CH3COONa溶液、1.0mol·L-1NaF溶液的pH | NaF溶液的pH>CH3COONa溶液的pH,证明CH3COOH的酸性比HF的酸性强 |
C | 比较氢氧化铜和氢氧化镁Ksp的大小 | 向浓度均为0.1mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入NaOH溶液 | 先出现蓝色沉淀,Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
D | 镀锌铁皮锌镀层厚度的测定 | 装有镀锌铁皮的烧杯中加入足量稀硫酸 | 产生气泡的速率突然减小,证明镀锌层完全反应 |
选项 | 实验操作、现象 | 实验结论 |
A | 将1~2mL水滴入盛有1~2g |
|
B | 往 | 不能说明非金属性 |
C | 纯净的 | 燃烧不一定需要 |
D | 在试管中加入0.5g淀粉和4mL 2mol/L | 淀粉没有水解 |
选项 | 实验操作和现象 | 结论 |
A | 向某钠盐粉末上滴加浓盐酸,产生的气体通入品红溶液中,品红溶液褪色 | 该钠盐为Na2SO3或NaHSO3 |
B | 向饱和FeSO4溶液中加入CuS固体,测得溶液中c( Fe2+)不变 | Ksp(CuS)<Ksp(FeS) |
C | 取某涂改液与KOH溶液混合加热,充分反应,取上层清液,加硝酸酸化的硝酸银溶液,有白色沉淀生成 | 涂改液中存在含氯化合物 |
D | 取少量乙酰水杨酸样品,加入3 mL蒸馏水和少量乙醇,振荡,再加入1~2滴FeCl3溶液,溶液变为紫色 | 乙酰水杨酸样品中可能含有水杨酸 |
装置 | 步骤 | 操作 | 现象 |
| ① | 打开止水夹,挤压胶头,使浓硝酸滴入试管 | 产生红棕色气体,溶液变为绿色 |
② | 一段时间后,关闭止水夹,推动注射器活塞使部分水进入试管 | 注射器内剩余的水被“吸入”试管;铜表面产生无色气泡,溶液变蓝,试管内气体逐渐变为无色 | |
③ | 一段时间后, 打开止水夹,拉动注射器活塞吸取少量无色气体;拔下注射器,再拉动活塞吸入少量空气 | 注射器中无色气体变红棕色 |
下列说法错误的是( )
|
|
|
|
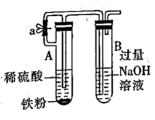
A.制取并收集 | B.通过控制止水夹a来制取 | C.配制 | D.观察钾的焰色反应 |
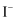
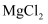 和
和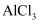 溶液的pH
溶液的pH , 则金属性:Mg>Al
, 则金属性:Mg>Al 的酸性强弱
的酸性强弱 溶液
溶液 离子
离子 溶液
溶液 气体的试管中,产生的气体使带火星的木条复燃
气体的试管中,产生的气体使带火星的木条复燃
 溶液中滴加稀盐酸,溶液中出现白色浑浊
溶液中滴加稀盐酸,溶液中出现白色浑浊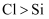
 在盛满
在盛满 的集气瓶中安静地燃烧,发出苍白色火焰
的集气瓶中安静地燃烧,发出苍白色火焰 溶液,加热。待反应充分后冷却溶液,向其中加入少量新制的
溶液,加热。待反应充分后冷却溶液,向其中加入少量新制的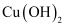 并加热,未出现砖红色沉淀
并加热,未出现砖红色沉淀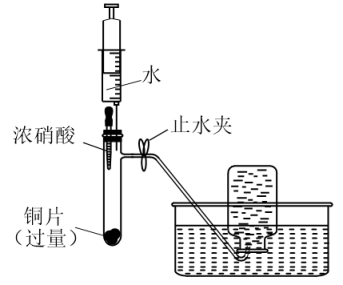


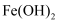
 溶液
溶液


