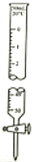酸(碱)式滴定管的使用 知识点题库
⑴称取Wg草酸晶体,配成100.00mL溶液
⑵取25.00mL所配溶液于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L-1的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为:2KMnO4+5H2(C2O)4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
①实验中,不需要的仪器有(填序号)
A、托盘天平(带砝码、镊子) B、滴定管 C、100mL的量筒
D、100mL的容量瓶 E、烧杯 F、漏斗 G、锥形瓶 H、玻璃棒
I、药匙 J、烧瓶
②实验中,标准液KMnO4溶液应装在式滴定管中,因为
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的x的值会(填偏大、偏小、无影响).
④在滴定过程中若用去amol•L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为mol•L-1 , 由此,x= .
⑤若滴定终点读数时俯视刻度,则计算的x值会(填偏大、偏小、无影响).

-
(1) 除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是。
-
(2) 酸化操作是加入盐酸,调节溶液的pH为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③。
-
(3) 测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;
B.量取25.00mL待测液于锥形瓶中;
C.用0.05000mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①上述测定过程中需用溶液润洗的仪器有:。
②计算上述样品中CaCl2·2H2O的质量分数为:。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有:;。


-
(1) 最适宜加热分解草酸晶体的装置是C。若选装置A可能会造成的后果是;若选装置B可能会造成的后果是。
-
(2) 实验利用装置“G(碱石灰)—F—D(CuO固体)—F”检验CO,则F中盛装的试剂是,证明含有CO的现象是。
-
(3) 可用0.10 mol/L酸性KMnO4标准溶液来滴定未知浓度的草酸溶液。
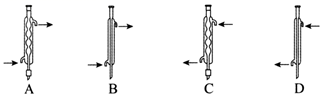
①滴定过程中发生反成的离子方程式为。②滴定过程中操作滴定管的图示正确的是。
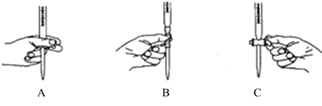
③判断反应达到滴定终点时的现象为。
 和
和  等结晶形式。某兴趣小组以废铁屑为原料制备
等结晶形式。某兴趣小组以废铁屑为原料制备  的主要流程:
的主要流程: 
相关信息如下:
①  吸湿性强。
吸湿性强。
②34℃时结晶得到  ,
,  加热至210℃得到
加热至210℃得到  。
。
请回答:
-
(1) 步骤①的目的是去除废铁屑表面的油污,方法是。
-
(2) 实验室模拟海水提取溴的过程中,用苯萃取溶液中的溴,选出其符合题意操作并按顺序列出字母:涂凡士林→检漏→()→()→()→()→()→清洗干净。
a.打开玻璃塞放气
b.打开旋塞放气
c.将溶液和苯转移至分液漏斗中,塞上玻璃塞
d.双手托住分液漏斗,右手压住玻璃塞,左手握住旋塞,上下颠倒振荡
e.右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转振荡
f.置于铁架台铁圈上静置,打开玻璃塞,将旋塞拧开,放出下层液体
g.从下口放出溴的苯溶液
h.从上口倒出溴的苯溶液
-
(3) 步骤④调pH=7,适宜加入的试剂是,通过调节分液漏斗的活塞可以控制添加液体的速率。当溶液pH接近7时,滴加试剂的分液漏斗的活塞应如图中的(填序号)所示。

-
(4) 下列有关说法正确的是________。A . 步骤②反应控制在40℃左右,原因是防止反应过于剧烈并减少液溴挥发 B . 步骤③滤渣成分只有
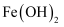 、
、 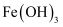 和
和 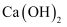 C . 为使
C . 为使  快速结晶,可用冰水浴进行冷却
D . 步骤⑤包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作
快速结晶,可用冰水浴进行冷却
D . 步骤⑤包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作
-
(5) 制得的
 可以通过如下步骤测定其纯度:①称取样品质量;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤,洗涤,干燥;④称量。
可以通过如下步骤测定其纯度:①称取样品质量;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤,洗涤,干燥;④称量。 若实验操作规范而测定结果偏低,其可能的原因是。

|
锥形瓶中的溶液 |
滴定管中的溶液 |
选用指示剂 |
选用滴定管 |
|
|
A |
碱 |
酸 |
石蕊 |
(乙) |
|
B |
酸 |
碱 |
酚酞 |
(甲) |
|
C |
碱 |
酸 |
甲基橙 |
(甲) |
|
D |
酸 |
碱 |
石蕊 |
(乙) |

-
(1) 酸式滴定管用蒸馏水洗净后,装入标准液前还应该进行的操作是。
-
(2) 若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会。(填“偏大”、“偏小”或不影响)
| 选项 | 实验操作内容 | 实验目的 |
| A | 将尖嘴垂直向下,挤压胶管内玻璃球将气泡排出 | 除去碱式滴定管胶管内的气泡 |
| B | 向盐酸酸化的Cu(NO3)2溶液中通入少量SO2 , 然后滴入BaCl2溶液,产生白色沉淀 | 证明Cu2+的氧化性大于H2SO4 |
| C | 将NaAlO2溶液与NaHCO3溶液混合,有白色絮状沉淀生成 | 证明AlO |
| D | 向盐酸中滴加Na2SO3溶液,产生使品红溶液褪色的气体 | 证明非金属性:Cl>S |
 的NaOH稀溶液滴定20mL某浓度的醋酸溶液,滴定情况随加入的氢氧化钠溶液的体积变化如下表所示。下列说法不正确的是( )
的NaOH稀溶液滴定20mL某浓度的醋酸溶液,滴定情况随加入的氢氧化钠溶液的体积变化如下表所示。下列说法不正确的是( ) | | 滴定情况 |
| 10 | 溶液 |
| 20 | 溶液 |
| 20.11 | 恰好中和 |
 mL时,
mL时,  B .
B .  mL时,
mL时,  C .
C .  mL时,
mL时,  D . 滴定过程中不可能出现
D . 滴定过程中不可能出现 
-
(1) I.制备葡萄糖酸(装置如图所示)。
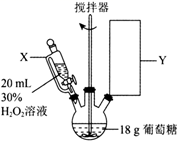
仪器X的名称为,Y处为冷凝回流装置,下列仪器使用正确且效果最好的是(填字母)。
-
(2) 滴入双氧水,水浴加热一段时间后,得到无色透明的葡萄糖酸溶液。反应的化学方程式为。
-
(3) Ⅱ.测定葡萄糖的转化率,确定合适的反应温度。
用移液管取出三口烧瓶中的反应液2.00mL置于锥形瓶中,以酚酞作为指示剂并加20mL蒸馏水稀释,用0.04mol·L-1NaOH标准溶液滴定。
①滴定管使用的正确的操作顺序为蒸馏水洗涤→标准液润洗→→→→→洗净→放回滴定管架(填字母)。
a.滴定结束后,记录刻度
b.调节液面至0刻度或0刻度略靠下,记录刻度
c.装入标准液并排净尖嘴处的气泡
d.将未滴定完的标准液回收
②达到滴定终点时的现象为。
③滴定过程消耗NaOH标准溶液的体积为V0mL,反应后三口烧瓶内溶液的体积为V1mL,实验条件下葡萄糖的转化率为(用含V0和V1的代数式表示)。
④若滴定终点时俯视读数,对转化率的影响为(填“偏高”“偏低”或“无影响”)。
-
(4) Ⅲ.制备葡萄糖酸钙。
将CaCO3分散于适量蒸馏水中形成浊液,加入葡萄糖酸,至无CO2气体放出为止,煮沸,并趁热采用下图装置抽滤,滤掉未反应的CaCO3 , 得到澄清透明的葡萄糖酸钙溶液。

抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是。
| 选项 | A | B | C | D |
| 实验目的 | 除去 | 蒸馏原油(石油) | 制备 | 用 |
| 实验装置 | | | | |
| 实验操作 | 在混合液中加入过量 | 在烧瓶中加入原油(石油),收集一定温度范围内的馏分 | 将 | 一手操作滴定管,控制滴定速度,一手晃动锥形瓶,眼睛注视滴定管刻度 |
-
(1) 一、 H2O2是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中H2O2的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6至10 天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1ml,滴定过程中发生的一个反应为:5H2C2O4+2MnO
 +6H+=2Mn2++10CO2↑+8H2O。(草酸不稳定,易分解)
+6H+=2Mn2++10CO2↑+8H2O。(草酸不稳定,易分解)②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
①中移取酸性高锰酸钾溶液滴定时所用主要仪器名称为
-
(2) 标定KMnO4标准液时需要控制温度为75至85℃,温度过低反应较慢,温度过高可能会因为 导致KMnO4标准液的标定浓度偏高,在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是
-
(3) KMnO4标准液滴定H2O2的离子方程式为 ,当滴定到 可以认为已达到滴定终点。
-
(4) 该医用消毒剂中H2O2的物质的量浓度为mol·L-1。
-
(5) 二、KMnO4是一种典型的强氧化剂。用酸性KMnO4溶液处理残留的Cu2S时,反应如下:KMnO4+Cu2S+H2SO4→ K2SO4+MnSO4+CuSO4+SO2↑+H2O
关于该反应的下列说法中错误的是
A 被氧化的元素是S
B KMnO4是氧化剂,Cu2S既是氧化剂又是还原剂
C 氧化剂与还原剂的物质的量之比为8:5
D 生成2.24L(标准状况)的SO2 , 转移电子的物质的量是0.8mol
E 氧化性的强弱关系是 MnO
 >Mn2+>Cu2+
>Mn2+>Cu2+
| A | B | C | D |
| | | | |
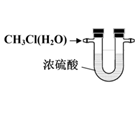
| 电泳实验证明Fe(OH)3胶体粒子带电 | 干燥一氯甲烷气体 | 排除盛有0.100 mol/L盐酸的滴定管中的气泡 | 测定酸碱中和反应的反应热 |
-
(1) 下列事实中,不能证明氢硫酸是弱酸的是____________ (填字母)。A . 氢硫酸不能与碳酸氢钠溶液反应放出CO2气体 B . Na2S易溶于水且能完全电离:Na2S = 2Na+ + S2- C . 0.1mol/L的氢硫酸的pH为4.5 D . 用等浓度的盐酸和氢硫酸做导电实验,盐酸导电性强于氢硫酸
-
(2) 某学生在实验室测定NaHS溶液的pH时,发现溶液呈碱性,则该溶液中各离子浓度的大小顺序为。
-
(3) 实验室中有一未知浓度的稀盐酸,某学生在实验室进行0.10 mol·L-1 NaOH标准溶液测定盐酸浓度的实验。请完成下列填空:
①取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用(填仪器名称)装配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
滴定次数
待测盐酸的体积/mL
标准NaOH溶液体积
滴定前的刻度/mL
滴定后的刻度/mL
第一次
20.00
0.40
20.50
第二次
20.00
4.10
24.00
第三次
20.00
1.00
24.00
②判断滴定达到终点的现象是。
③根据上述数据,可计算该盐酸的浓度约为mol·L-1(保留两位小数)。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有(填字母)。
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.碱式滴定管滴定前读数时俯视读数
D.碱式滴定管滴定终点读数时俯视读数
E.碱式滴定管滴定前尖嘴部分有气泡,滴定后消失
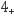 +6HCHO=3H+ + 6H2O+ (CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与1 molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
+6HCHO=3H+ + 6H2O+ (CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与1 molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:步骤I :称取(NH4)2SO4样品1. 500 g;
步骤II :将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀;
步骤III :移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用0.1010 mol·L-1NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
回答下列问题:
-
(1) 碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”“偏低”或“无影响”)。
-
(2) 锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积(填“偏大”“偏小”或“无影响”)。
-
(3) 滴定时边滴边摇动锥形瓶,眼睛应观察。
-
(4) 滴定达到终点时,溶液颜色由色变成色。
-
(5) 滴定结果如下表所示:
滴定次数
待测溶液的体积/mL
标准溶液的体积/mL
滴定前刻度
滴定后刻度
1
25.00
1.02
21.03
2
25.00
2.00
21.99
3
25.00
0.20
20.20
该样品中氮的质量分数为%(保留2位小数)。
选项 | A | B | C | D |
目的 | 准确量取25.00mLNaOH溶液 | 测定中和热 | 粗铜精炼 | 比较 |
装置或操作 |
|
|
|
|
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
B . 若用HNO3酸化KMnO4标准溶液,会使测定结果偏低
C . 该实验应该使用酚酞做指示剂来确定滴定终点
D . KMnO4标准溶液应盛放在酸式滴定管中
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
B . 若用HNO3酸化KMnO4标准溶液,会使测定结果偏低
C . 该实验应该使用酚酞做指示剂来确定滴定终点
D . KMnO4标准溶液应盛放在酸式滴定管中
 结合质子的能力强于CO
结合质子的能力强于CO 
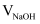


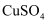 溶液中的
溶液中的 
 晶体
晶体 标准溶液滴定位未知浓度的稀硫酸
标准溶液滴定位未知浓度的稀硫酸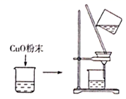



 粉末,使
粉末,使 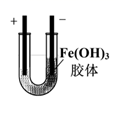
 的Ka和
的Ka和 的Ka1大小
的Ka1大小