酸(碱)式滴定管的使用 知识点题库
-
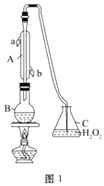
(1) 仪器A的名称是,水通入A的进口为。
-
(2) B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为。
-
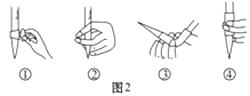
(3) 除去C中过量的H2O2 , 然后用0.090 0 mol·L-1 NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的;若滴定终点时溶液的pH=8.8,则选择的指示剂为;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
-
(4) 滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为g·L-1。
-
(5) 该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:。
已知:H2O2可看作二元弱酸,它的一级电离常数Ka1=1.55×10-12

-
(1) Ⅰ.检测二氧化硫的含量
仪器A的名称是。
-
(2) B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中过量H2O2溶液充分反应,C中发生反应的化学方程式为。
-
(3) 用0.0900 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 (填编号)。向C中所得溶液中滴加几滴酚酞试剂,滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为 g·L-1。
-
(4) 该测定结果比实际值偏高,分析原用可能是(任答一条即可),
-
(5) 本实验中所用的H2O2溶液的浓度,常用KMnO4标准溶液进行测定,H2O2可看作二元弱酸,但一般不利用酸碱中和滴定法过行测定的原因任答一条即可)。
-
(6) Ⅱ.分析H2O2的催化分解原理
碱性介质中H2O2分解远比酸性介质中快,NaOH可促使H2O2失去质子,请写出H2O2与NaOH溶液反应生成的酸式盐的电子式。
-
(7) I-催化H2O2分解的原理分为两步,总反应可表示为:
2H2O2(aq)=2H2O(l)+O2(g) △H<0
若第一步反应为 H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应
则第二步反应为△H <0 快反应
-
(8) 能正确的表示I-催化H2O2分解真理的示意图为。

-
(1) 将准确称取的4.3 g烧碱样品配成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有。
-
(2) 取10.00 mL待测液,用滴定管量取。(填“酸式”或“碱式”)
-
(3) 用0.2000 mol·L-1标准盐酸滴定待测烧碱溶液,若选择酚酞为指示剂,则判断刚好到达终点的方法为。
-
(4) 根据下列数据,烧碱的纯度为。
滴定次数
待测液体积(mL)
标准盐酸体积(mL)
滴定前读数(mL)
滴定后读数(mL)
第一次
10.00
0.50
20.48
第二次
10.00
4.00
24.02
-
(5) 以标准的盐酸滴定未知浓度的氢氧化钠溶液为例,判断下列操作引起的误差(填“偏大”、“偏小”、“无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视;
②用待测液润洗锥形瓶;
③滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁。
| A | B | C | D |
| | | | |
| 向该装置中加入金属Zn和稀硫酸,并关闭活塞,用于检查装置的气密性 | 记录滴定终点读数为12.20mL | 灼烧胆矾晶体使其分解 | 分离含淀粉和葡萄糖的溶液 |
-
(1) (一)高锰酸钾的制备流程如下

实验设计中,KOH和KClO3过量的目的是
操作①中所用的坩埚及搅拌棒材质可以是(填“铁”“陶瓷”““氧化铝”);熔融时生成K2MnO4的反应中,氧化剂与还原剂的物质的量之比为。
-
(2) 操作③发生反应的离子方程式为
-
(3) 操作④过滤时不能用酒精洗涤以加快干燥速度,原因是.
-
(4) (二)高锰酸钾纯度测定:
I.称取ag样品配成100mL溶液;
Ⅱ.称取bgNa2C2O4于250mL锥形瓶中,加40mL水及10Ml 5mol·-1硫酸溶解;
Ⅲ.加热到70~80℃,趁热用KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。
滴定时,KMnO4溶液应盛放在(填“酸式”或“碱式”)滴定管中。
-
(5) 样品中KMnO4的纯度为(用含a、b、V的代数式表示)。

-
(1) 用标准NaOH溶液滴定时,应将标准NaOH溶液注入(填“甲”或“乙”)中。
-
(2) 某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是→→→→A→(用字母序号填写)。判断到达滴定终点的实验现象是
-
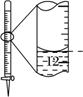
(3) 右上图是碱式滴定管中液面在滴定前后的读数, c(HCl)= mol·L-1。
-
(4) 由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。A . 中和滴定达终点时俯视滴定管内液面读数 B . 酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定 C . 碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定 D . 用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
①用蒸馏水洗涤碱式滴定管,注入0.2000 mol/L的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“ 0”或“0”刻度线稍下,并记下读数;④量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴甲基橙溶液;⑤用标准液滴定至终点,记下滴定管液面读数。⑥重复以上滴定操作2-3次。请回答:
-
(1) 以上步骤有错误的是(填编号)
-
(2) 步骤④中,量取20.00 mL待测液应使用(填仪器名称)
-
(3) 步骤⑤滴定时眼睛应注视;判断到达滴定终点的依据是:。
-
(4) 以下是实验数据记录表
滴定
次数
盐酸体积
(mL)
NaOH溶液体积读数(mL)
滴定前
滴定后
1
20.00
0.00
18.10
2
20.00
0.00
16.20
3
20.00
0.00
16.16
从表中可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是
A. 锥形瓶装液前,留有少量蒸馏水 B. 滴定结束时,仰视读数
C.滴定前滴定管尖嘴无气泡,滴定结束有气泡 D.锥形瓶用待测液润洗
E. NaOH标准液保存时间过长,有部分变质
-
(5) 根据表中记录数据,通过计算可得,该盐酸浓度为: mol/L
-
(1) 步骤①加入的指示剂是。
-
(2) 步骤②应使用式滴定管。
-
(3) 步骤③当待测液由色变为色且不再变化即达终点,若耗去Na2S2O3溶液20.0 mL,则废水中Cl2的物质的量浓度为。
-
(4) Cl2的实际浓度比所测浓度为(填“偏大”、“偏小”或“相等”),造成误差的原因是(若认为没有误差,该问不答)。
-
(1) 该反应的离子方程式是。
-
(2) 盛放高锰酸钾溶液的是 (填“酸式”或“碱式”)滴定管,其原因是。
-
(3) 滴定终点的现象为。
-
(4) 若某次滴定开始和结束时,滴定管中的液面如图所示,则终点的读数为mL。小明同学根据 3 次实验求得平均消耗高锰酸钾溶液的体积为 VmL,请计算该 H2C2O4溶液的物质的量浓度为mol/L

-
(5) 下列操作使测定结果偏低的是___(填字母)。A . 酸式滴定管未用标准液润洗直接注入 KMnO4标准液 B . 滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥 C . 酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡 D . 读取 KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
| 选项 | 锥形瓶中的溶液 | 滴定管中的溶液 | 指示剂 | 滴定管 |
| A | 碱 | 酸 | 石蕊 | 乙 |
| B | 酸 | 碱 | 酚酞 | 甲 |
| C | 碱 | 酸 | 甲基橙 | 甲 |
| D | 碱 | 酸 | 酚酞 | 乙 |
甲 ![]() 乙
乙 ![]()

-
(1) ①燃料电池是一种绿色环保、高效的化学电源。上图为甲醇燃料电池,则负极反应式为。
②用甲醇燃料电池电解300mL饱和食盐水,则电解的化学方程式为。电解一段时间后,当溶液的pH值为13时,消耗O2的质量为g。(忽略溶液体积变化,不考虑损耗)
③用甲醇燃料电池电解2L,1mol/L硫酸铜溶液,一段时间后:两极共收集到标准状况下的气体89.6L,则电路中共转移mol电子。
-
(2) 利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-废水,如下图所示;电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。

①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5 , 可循环使用,则石墨Ⅱ附近发生的电极反应式为。
②向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=1.0×10-32 , 要使c(Cr3+)降至10-5mol•L-1 , 溶液的pH应调至。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=1.0×10-32 , 要使c(Cr3+)降至10-5mol•L-1 , 溶液的pH应调至。

已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:

-
(1) 第一次读数为mL。
-
(2) 滴定终点的判断方法。
-
(3) 经过计算,此碘盐碘元素的含量为mg·kg-1(用含a、b的最简表达式表示) 。
-
(4) 下列操作可能会导致测量结果偏低的是 。A . 步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g B . 步骤1所配食盐溶液未完全转移至锥形瓶 C . 步骤2中滴定管洗涤后未润洗 D . 步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失
-
(1) 合成该物质的步骤如下:
步骤1:配制0.5mol·L-1 MgSO4溶液和0.5mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500mL NH4HCO3溶液于1000mL三颈烧瓶中,开启搅拌器。温度控制在50℃。
步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1h后,过滤,洗涤。
步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
①步骤2控制温度在50℃,较好的加热方法是。
②步骤3生成MgCO3·nH2O沉淀的化学方程式为。
③步骤4检验沉淀是否洗涤干净的方法是。
-
(2) 测定生成的MgCO3·nH2O中的n值。
称量1.000碳酸镁晶须,放入如图所示的广口瓶中加入适量水,并滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后将烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。

①图中气球的作用是。
②上述反应后期要升温到30℃,主要目的是。
③测得每7.8000g碳酸镁晶须产生标准状况下CO2为1.12L,则n值为。
-
(3) 碳酸镁晶须可由菱镁矿获得,为测定某菱镁矿(主要成分是碳酸镁,含少量碳酸亚铁、二氧化硅)中铁的含量,在实验室分别称取12.5g菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,加入指示剂,用0.010mol/L H2O2溶液进行滴定。平行测定四组。消耗H2O2溶液的体积数据如表所示。
实验编号
1
2
3
4
消耗H2O2溶液体积/mL
15.00
15.02
15.62
14.98
①H2O2溶液应装在(填“酸式”或“碱式”)滴定管中。
②根据表中数据,可计算出菱镁矿中铁元素的质量分数为 %(保留小数点后两位)。

| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | NaOH溶液 | H2SO4溶液 | 石蕊 | 乙 |
| B | H2SO4溶液 | NaOH溶液 | 酚酞 | 甲 |
| C | NaOH溶液 | H2SO4溶液 | 甲基橙 | 乙 |
| D | H2SO4溶液 | NaOH溶液 | 酚酞 | 乙 |

-
(1) 仪器g的名称是,若用装置H收集氯气,气体应从(填“a”或“b”)进入。
-
(2) 装置的连接顺序依次为A→→→→→→→F,装置G的作用是:。
-
(3) NaH2BO3的电离方程式为。
-
(4) 实验完成后,某同学向装置F中(溶液含有0.1mol∙L-1NaClO、0.1mol∙L-1NaCl、0.2mol∙L-1NaOH)滴加品红溶液,发现溶液褪色。现设计实验探究溶液褪色的原因。
实验序号
0.2mol∙L-1NaClO/mL
0.2mol∙L-1NaCl/mL
0.4mol∙L-1NaOH/mL
H2O/mL
品红溶液
现象
Ⅰ
0.0
15.0
15.0
0.0
4滴
不褪色
Ⅱ
15.0
0.0
15.0
0.0
4滴
缓慢褪色
Ⅲ
15.0
0.0
0.0
x
4滴
较快褪色
则x=,由实验得出的结论是。
-
(5) NaOH溶液常用于酸碱中和滴定。在规格为50.00mL的碱式滴定管中,若NaOH溶液起始读数为20.00mL,此时滴定管中NaOH溶液的实际体积为。
-
(6) H3BO3可由硼砂(Na2B4O7∙10H2O)与盐酸在加热的条件下反应制得,该反应的化学方程。
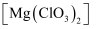 常用作催熟剂、除草剂等,实验室制备少量
常用作催熟剂、除草剂等,实验室制备少量  的流程如下:
的流程如下: 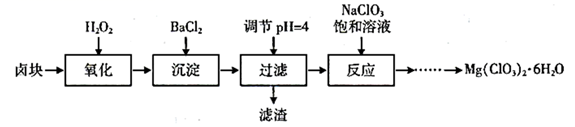
已知:卤块主要成分为  ,含有
,含有 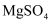 、
、  等杂质。
等杂质。
-
(1) 加入
 的目的是除去杂质离子,检验杂质离子已沉淀完全的方法是。
的目的是除去杂质离子,检验杂质离子已沉淀完全的方法是。
-
(2) 实验室常利用卤块先制备出
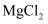 溶液,再加入
溶液,再加入  饱和溶液发生反应为:
饱和溶液发生反应为: 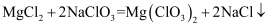 ,再进一步制取
,再进一步制取  。该过程的实验步骤依次为:①蒸发结晶;②趁热过滤;③;④过滤、洗涤、干燥。
。该过程的实验步骤依次为:①蒸发结晶;②趁热过滤;③;④过滤、洗涤、干燥。
-
(3) 产品中
 含量的测定。已知:
含量的测定。已知: 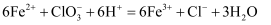 ,
,  的摩尔质量为
的摩尔质量为 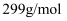 ,下图是几种物质的溶解度随温度的变化情况。
,下图是几种物质的溶解度随温度的变化情况。 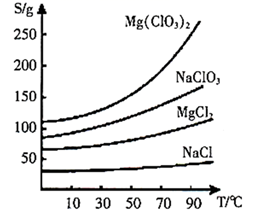
步骤1:准确称量
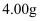 产品配成
产品配成 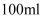 溶液。
溶液。步骤2:取
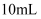 于锥形瓶中,加入
于锥形瓶中,加入 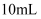 稀硫酸和
稀硫酸和 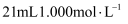 的
的 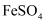 溶液,微热。
溶液,微热。步骤3:冷却至室温,用
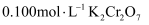 溶液滴定至终点,此过程中反应的离子方程式为
溶液滴定至终点,此过程中反应的离子方程式为 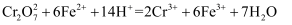 。
。步骤4:将步骤2、3重复两次,平均消耗
 溶液
溶液 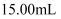 。
。①产品中
 的质量分数为。
的质量分数为。②在测定过程中,使用酸式滴定管滴定,选出其正确操作并按序列出字母:检查是否漏水→蒸馏水洗涤→
 标准液润洗滴定管→→→→→到达滴定终点,停止滴定,记录读数→重复操作2~3次
标准液润洗滴定管→→→→→到达滴定终点,停止滴定,记录读数→重复操作2~3次a. 轻轻转动酸式滴定管的活塞,使滴定管尖嘴部分充满溶液,无气泡
b. 调整管中液面至“0”或“0”刻度以下,记录读数
c. 调整管中液面,用胶头滴管滴加标准液恰好到“0”刻度
d. 锥形瓶放于滴定管下,边摇边滴定,眼睛注视锥形瓶内颜色变化
e. 装入
 溶液至“0”刻度以上
溶液至“0”刻度以上 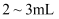 ,固定好滴定管
,固定好滴定管f. 锥形瓶放于滴定管下,边摇边滴定,眼睛注视滴定管内液面变化
g. 加入指示剂
③下列关于滴定分析,正确的是。
A. 使用碱式滴定管时捏住乳胶管中玻璃球的偏下部位,挤捏乳胶管
B. 滴定前,锥形瓶和滴定管均须用标准溶液润洗
C. 滴定前平视,滴定终点俯视,则滴定测得的体积比实际消耗的小
D. 滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得体积比实际消耗的小
①将酸式滴定管用蒸馏水洗净,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从酸式滴定管中放出25.00mL待测溶液到锥形瓶中。
②将碱式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol·L-1标准NaOH溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗NaOH溶液的体积为V1mL。
④若按正确操作进行三次实验,其消耗的NaOH溶液的体积见下表:
次数 | 1 | 2 | 3 |
体积(mL) | 12.48 | 12.52 | 12.04 |
试回答下列问题:
-
(1) 达到滴定终点时的现象为;该盐酸溶液的浓度为;
-
(2) 该小组在步骤①中的不正确是,由此造成的测定结果(填“偏高”或“偏低”或“无影响”);
-
(3) 如图是某次滴定时的碱式滴定管中的液面,其读数为mL;