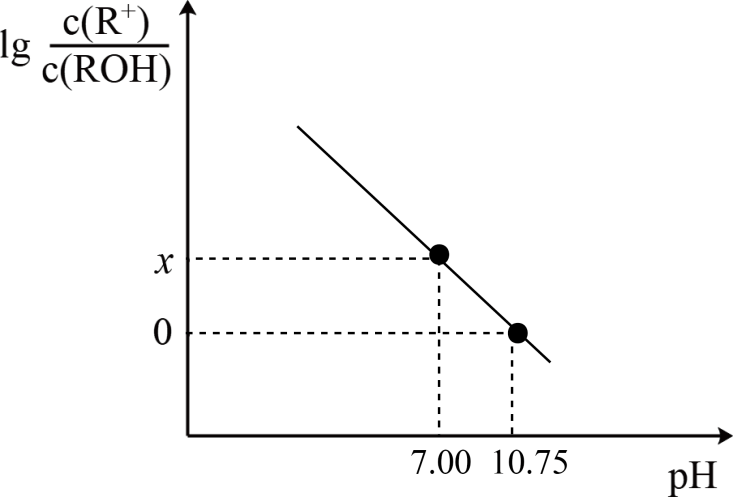
中和滴定 知识点题库
下列说法正确的是( )
 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
 D .
D . 
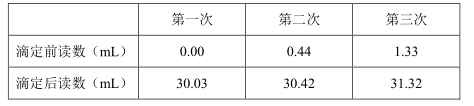
其实验步骤及相关数据如下。
①标准液的稀释:移取浓度为0.008000mol•L-1的碘标准溶液20.00mL于200mL容量瓶中,定容,摇匀备用。
②移取10.00mL饮料样品(设密度为1.0g•cm-3)于250mL锥形瓶中,加入50mL蒸馏水,2mL指示剂。
③在滴定管中装入稀释后的标准液进行滴定至终点,读取并记录相关数据。
④重复测定3次,数据记录如下表。
回答下面的问题:
-
(1) 实验中盛装标准溶液应选择(填“酸式”或“碱式”)滴定管。滴定前为何要稀释标准溶液?。
-
(2) 步骤2中加入的指示剂是,判断滴定达到终点的现象是。
-
(3) 实验中下列操作可能导致测定结果偏低的是_________A . 稀释标准溶液定容时俯视刻度线 B . 滴定结束读数时俯视读数 C . 在锥形瓶中加入样品后放置较长时间才开始滴定 D . 滴定管尖嘴部分有气泡,滴定后消失
-
(4) 计算该饮料样品中维生素C含量为mg/100g。由滴定结果判断该饮料(填“是”或“不是”)天然汁。
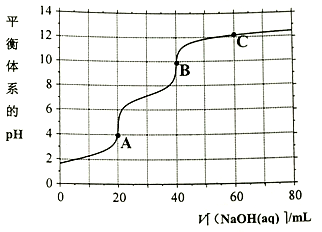
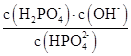 相等
D . B点溶液存在2c(Na+)=c(PO43-)+c(H2PO4-)+c(HPO42-)+c(H3PO4)
相等
D . B点溶液存在2c(Na+)=c(PO43-)+c(H2PO4-)+c(HPO42-)+c(H3PO4)
-
(1) 写出酸性KMnO4溶液和H2C2O4的离子方程式。
-
(2) 配制100mL0.0400mol·L-1的H2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是。
-
(3) 将KMnO4溶液逐滴滴入一定体积的酸性H2C2O4溶液中(温度相同,并振荡),记录的现象如下:
滴入KMnO4溶液的次序
KMnO4溶液紫色褪去所需的时间
先滴入第1滴
60s
褪色后,再滴入第2滴
15s
褪色后,再滴入第3滴
3s
褪色后,再滴入第4滴
1s
请分析KMnO4溶液褪色时间变化的可能原因。
-
(1) 准确称取一定质量的固体NaOH配成250 mL标准溶液。需要的仪器有天平、烧杯、量筒、玻璃棒、、(填仪器名称)。
-
(2) 若选择酚酞作指示剂,滴定时左手控制酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视。到达滴定终点时的现象是:.
-
(3) 下列各项操作可能会给实验结果造成误差,请用A.偏高;B.偏低;C.无影响填写(填序号)
①将NaOH溶液放入锥形瓶时,加入少量蒸馏水稀释 ,
②酸式滴定管装入盐酸前未用该盐酸润洗 ,
③滴定前读数时仰视,滴定完毕读数时俯视 ,
④滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 ,
I.三草酸合铁(Ⅲ)酸钾晶体的制备
①将5g(NH4)2Fe(SO4)2·6H2O晶体溶于20mL水中,加入5滴6 mol·L-1H2SO4酸化,加热溶解,搅拌下加入25mL饱和H2C2O4溶液,加热,静置,待黄色的FeC2O4沉淀完全以后,倾去上层清液,倾析法洗涤沉淀2-3次。
②向沉淀中加入10mL饱和草酸钾溶液,水浴加热至40℃,用滴管缓慢滴加12mL5%H2O2 , 边加边搅拌并维持在40℃左右,溶液成绿色并有棕色的沉淀生成。
③加热煮沸一段时间后,再分两批共加入8mL饱和H2C2O4溶液(先加5mL,后慢慢滴加3mL)此时棕色沉淀溶解,变为绿色透明溶液。
④向滤液中缓慢加入10mL95%的乙醇,这时如果滤液浑浊可微热使其变清,放置暗处冷却,结晶完全后,抽滤,用少量洗涤剂洗涤晶体两次,抽干,干燥,称量,计算产率。
已知制备过程中涉及的主要反应方程式如下:步骤②6FeC2O4+3H2O2+6K2C2O4=4K3[Fe(C2O4)3]+2Fe(OH)3 , 步骤③2Fe(OH)3+3H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O,请回答下列各题:
-
(1) 简述倾析法的适用范围,步骤③加热煮沸的目的是。
-
(2) 下列物质中最适合作为晶体洗涤剂的是____________________(填编号)。A . 冷水 B . 丙酮 C . 95%的乙醇 D . 无水乙醇
-
(3) 有关抽滤如图,下列说法正确的是。
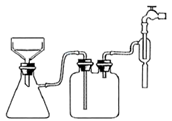
A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B.右图所示的抽滤装置中,只有一处不正确,即漏斗颈口斜面没有对着吸滤瓶的支管口
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸
-
(4) Ⅱ.纯度的测定
称取1.000g产品,配制成250mL溶液,移取25.00mL溶液,酸化后用标定浓度为0.01000 mol·L-1的高锰酸钾溶液滴定至终点,三次平行实验平均消耗高锰酸钾溶液24.00mL。
滴定涉及反应的离子方程式:。
-
(5) 计算产品的纯度(用质量百分数表示)。(K3[Fe(C2O4)3]·3H2O的相对分子质量为491)
-
(1) 醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为。
② 下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是(填字母序 号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
-
(2) Ⅰ.两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠。实验室现有醋酸钠固体,取少量溶于水,溶液呈(选填“酸性”、“中性”或“碱性”),其原因是(用离子方程式表示)。
Ⅱ.用 0.1 mol·L-1 NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1 的盐酸和醋酸溶液,得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
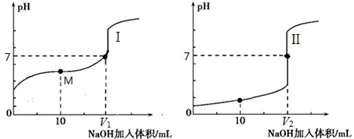
①滴定醋酸的曲线是(填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的 c(H+)最大的是。
③ V1 和 V2 的关系:V1V2(填“>”、“=”或“<”)。
④ M 点对应的溶液中,各离子的物质的量浓度由大到小的顺序是。
-
(3) 为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。 资料:AgSCN 是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤
现象
步骤 1:向 2 mL 0.005 mol·L-1 AgNO3 溶液中加入 2 mL 0.005 mol·L-1 KSCN 溶液,静置。
出现白色沉淀。
步骤 2:取 1 mL 上层清液于试管中,滴加 1 滴 2 mol·L-1Fe(NO3)3 溶液。
溶液变红色。
步骤 3:向步骤 2 的溶液中,继续加入 5 滴 3 mol·L-1 AgNO3溶液。
现象 a ,溶液红色变浅。
步骤 4:向步骤 1 余下的浊液中加入 5 滴 3 mol·L-1 KI 溶液。
白色沉淀转化成黄色沉淀。
① 写出步骤 2 中溶液变红色的离子方程式。
② 步骤 3 中现象 a 是。
③ 用化学平衡原理解释步骤 4 的实验现象。
-
(4) 某小组模拟工业上回收分银渣中的银,过程如下:

过程 I 的主要反应:AgCl+2


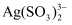 +Cl-
+Cl-过程 II 的离子反应:4
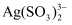 +6OH- +HCHO=4Ag++8
+6OH- +HCHO=4Ag++8  +4H2O+
+4H2O+ 
Ⅲ中回收液可直接循环使用,但循环多次后,I 中的银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:。
提示:2KMnO4+5K2SO3+3H2SO4=6K2SO4+2MnSO4+3H2O、I2+Na2S=2NaI+S↓
| 选项 | 滴定管中的溶液 | 锥形瓶中的溶液 | 指示剂 | 滴定终点颜色变化 |
| A | NaOH溶液 | CH3COOH溶液 | 酚酞 | 无色→浅红色 |
| B | HCl溶液 | 氨水 | 甲基橙 | 黄色→橙色 |
| C | 酸性KMnO4溶液 | K2SO3溶液 | 无 | 无色→浅紫红色 |
| D | 碘水 | Na2S溶液 | 淀粉 | 蓝色→无色 |

-
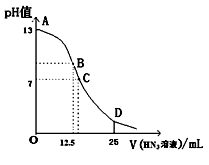
(1) 该氢氧化钠溶液的物质的量浓度为mol/L-1。
-
(2) A点对应酸的体积为12.5mL,则所得混合溶液中由水电离出的c(OH-)=mol/L-1。
-
(3) 在B点所得混合溶液中,c(Na+)、c(A-)、c(H+)、c(OH-)由大到小的顺序是。
-
(4) 在C点所得混合溶液中,下列说法正确的是____________(填字母序号)。A . HA的电高程度大于NaA的水解程度 B . 离子浓度由大到小的顺序是c(Na+)>c(A-)>c(H+)>c(OH-) C . c(Na+)+ c(H+)= c(A-)+c(OH-) D . c(HA)+ c(A-)=0.2 mol·L-1
 某二元酸
某二元酸  ,滴加
,滴加 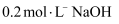 溶液。已知
溶液。已知  ,
,  。下列说法错误的是( )
。下列说法错误的是( )
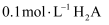 溶液中有
溶液中有  B . 当用去
B . 当用去  溶液体积
溶液体积 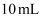 时,溶液的
时,溶液的 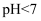 ,此时溶液中有
,此时溶液中有  C . 当滴加至中性时,溶液中
C . 当滴加至中性时,溶液中  ,用去
,用去  溶液的体积小于
溶液的体积小于 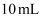 D . 当用去
D . 当用去  溶液体积
溶液体积 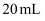 时,此时溶液中有
时,此时溶液中有 
-
(1) Ⅰ、探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol•L-1 H2C2O4溶液、0.010 mol•L-1 KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量
V(H2C2O4溶液)/mL
V(蒸馏水)/mL
V(KMnO4溶液)/mL
T/℃
乙
①
2.0
0
4.0
50
②
2.0
0
4.0
25
③
2.0
a
3.0
25
完成该反应的实验原理:+
 + = CO2↑ + Mn2+ + H2O
+ = CO2↑ + Mn2+ + H2O -
(2) 上述实验①、②是探究对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则 a 为;乙是实验需要测量的物理量,则表格中“乙”应填写。
-
(3) Ⅱ、测定H2C2O4•xH2O中x值。已知:M(H2C2O4) = 90 g•mol-1。①称取1.260 g 纯草酸晶体,将草酸制成 100.00 mL 水溶液为待测液; ②取 25.00 mL 待测液放入锥形瓶中,再加入适量的稀 H2SO4; ③用浓度为 0.05 000 mol•L-1的KMnO4标准溶液进行滴定。
某学生的滴定方式(夹持部分略去)如下,最合理的是(选填 a、b)。由图可知消耗 KMnO4溶液体积为 mL。
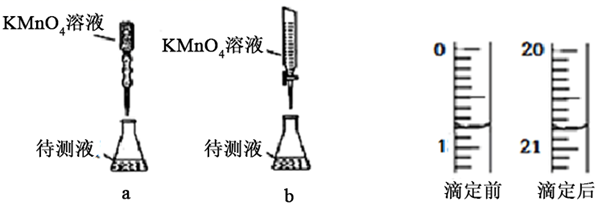
-
(4) 滴定终点锥形瓶内现象为。
-
(5) 通过上述数据,求得 x =。
-
(6) 下列操作会造成所测x偏大的是____________(填字母)。A . 滴定终点俯视读数 B . 锥形瓶用待测溶液润洗 C . 滴定前有气泡,滴定后没有气泡 D . 配制100 mL待测溶液时,有少量溅出
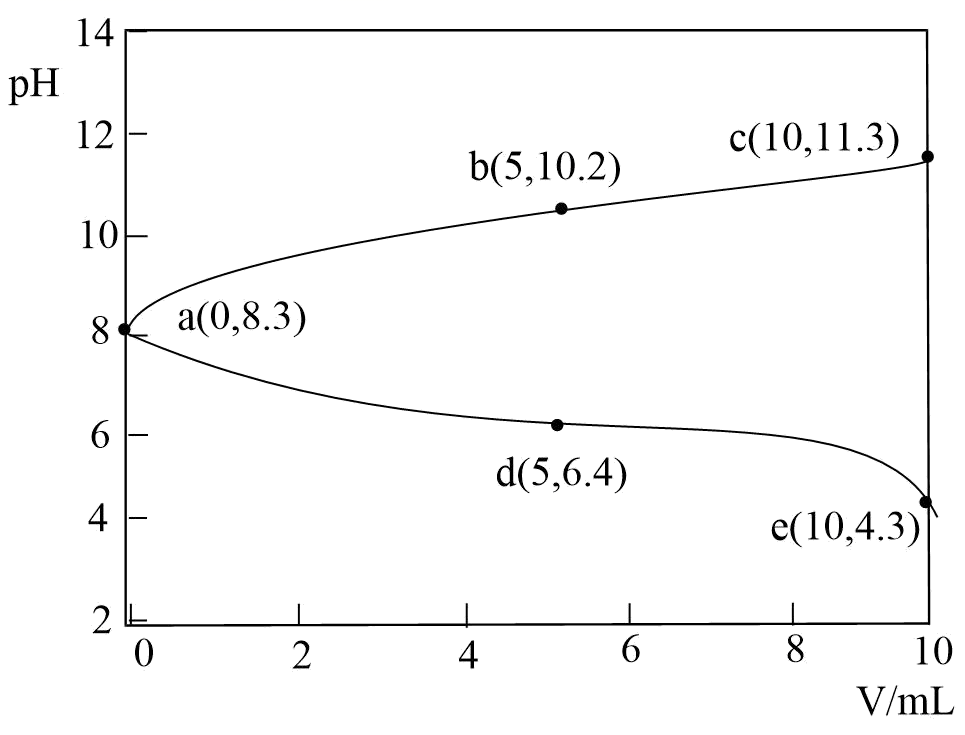
下列说法错误的是( )
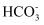 的水解程度大于电离程度
B .
的水解程度大于电离程度
B .  过程中:
过程中: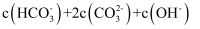 逐渐减小
C .
逐渐减小
C .  过程中:
过程中: D . e点溶液中:c(Na+) = c(Cl-) = 0.025 mol•L-1
D . e点溶液中:c(Na+) = c(Cl-) = 0.025 mol•L-1
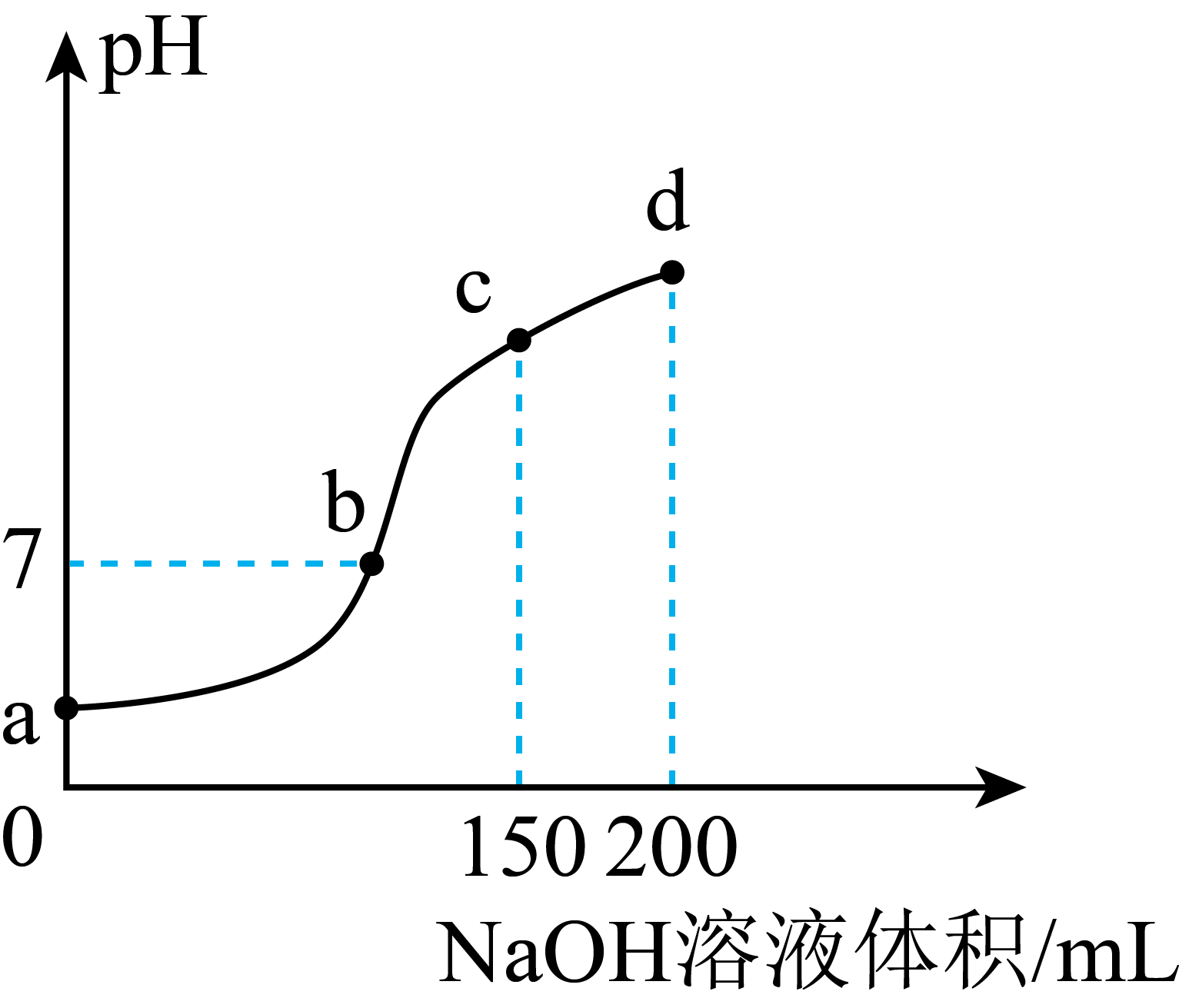
 )+c(H+)= 2c(
)+c(H+)= 2c( ) +c(OH-)
B . b点溶液中,加入NaOH溶液的体积大于100 mL
C . c点溶液中,c(Na+)>c(
) +c(OH-)
B . b点溶液中,加入NaOH溶液的体积大于100 mL
C . c点溶液中,c(Na+)>c( )>c(
)>c( )>c(NH3·H2O)
D . d点溶液中,c(Na+)=c(
)>c(NH3·H2O)
D . d点溶液中,c(Na+)=c( )+c(NH3·H2O)
)+c(NH3·H2O)
 的关系如图所示。下列说法错误的是( )
的关系如图所示。下列说法错误的是( )