原子核外电子排布 知识点题库
硼和氮元素在化学中有很重要的地位,回答下列问题:
-
(1) 基态硼原子核外电子有种不同的运动状态,基态氮原子的价层电子排布图为.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为.
-
(2) 化合物H3BNH3是一种潜在的储氢材料,可利用化合物B3N3H6通过如下反应制得:3CH4+2B3N3H6+6H2O═3CO2+6H3BNH3
①H3BNH3分子中是否存在配位键(填“是”或“否”),B、C、N、O的第一电离能由小到大的顺序为.
②与B3N3H6互为等电子体的分子是(填一个即可),B3N3H6为非极性分子,根据等电子原理写出B3N3H6的结构式.
-
(3) “嫦娥五号”探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质,回答下列问题:
①SeO3分子的立体构型为.
②金属铜投入氨水或H2O2溶液中均无明显现象,但投入氨水与H2O2的混合溶液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子反应方程式为.
③某种铜合金的晶胞结构如图所示,该晶胞中距离最近的铜原子和氮原子间的距离为
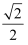 apm,则该晶体的密度为(用含a的代数式表示,设NA为阿伏加德罗常数的值).
apm,则该晶体的密度为(用含a的代数式表示,设NA为阿伏加德罗常数的值).
若aAn+与 bB2﹣两种离子的核外电子层结构相同,则a等于( )
A . b+n﹣2
B . b+n+2
C . b﹣n﹣2
D . b﹣n+2
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
-
(1) 写出基态As原子的核外电子排布式.
-
(2) 根据元素周期律,原子半径GaAs,第一电离能GaAs.(填“大于”或“小于”)
-
(3) AsCl3分子的立体构型为,其中As的杂化轨道类型为.
-
(4) GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是.
-
(5) GaAs的熔点为1238℃,密度为ρ g•cm﹣3 , 其晶胞结构如图所示.该晶体的类型为,Ga与As以键键合.Ga和As的摩尔质量分别为MGa g•mol﹣1和MAs g•mol﹣1 , 原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA , 则GaAs晶胞中原子的体积占晶胞体积的百分率为.

下列分子中所有原子都满足最外层8电子结构的是( )
A . 五氯化磷
B . 二氧化硫
C . 二氟化氙
D . 光气(COCl2)
下列说法中正确的是( )
A . [Ne]3s2表示的是Mg原子
B . 3p2表示第三能层有2个电子
C . 同一原子中,1s、2s、3s电子的能量逐渐减小
D . 2p、3p、4p能级容纳的最多电子数依次增多
铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4【UO2(CO3)3】等。回答下列问题:
-
(1) UF4用Mg或Ca还原可得金属铀。金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为;基态钙原子核外电子排布式为;熔点:MgO(2852℃)高于CaO(2614℃),其原因是。
-
(2)
 。NH4HF2中所含作用力有(填字母)。
。NH4HF2中所含作用力有(填字母)。 a. 氢键 b. 配位键 c. 共价键 d. 离子键 e. 金属键
-
(3) 已知:
 .
. ①NH4+ 的空间构型为,与NH4+ 互为等电子体的分子或离子有(写两种)
②CO32- 中碳原子杂化轨道类型为。
③分解产物中属于非极性分子的是(填字母)。
a. NH3 b. CO2 c. N2 d. H2O
-
(4) UO2 的晶胞结构及晶胞参数如下图所示:

①晶胞中U的配位数为。
②UO2 的密度为g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
磷原子中的不成对电子,不同的是( )
A . 电子云形状
B . 电子云伸展方向
C . 电子能量
D . 电子自旋状态
下列表达方式错误的是( )
A . CO2 的分子模型示意图:  B . 甲烷的电子式
B . 甲烷的电子式 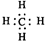 C . 硫离子核外电子排布式1s22s22p63s23p6
D . 碳-12原子构成
C . 硫离子核外电子排布式1s22s22p63s23p6
D . 碳-12原子构成  C
C
 B . 甲烷的电子式
B . 甲烷的电子式  C
C
下列说法错误的是( )
A . 某外围电子排布为4d15s2基态原子,该元素位于周期表中第五周期第ⅢB族
B . 在元素周期表中,s区,d区和ds区的元素都是金属元素
C . 当碳原子的核外电子排布由  转变为
转变为  时,释放能量,由激发态转化成基态
D . 非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8
时,释放能量,由激发态转化成基态
D . 非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8
有如下三种微粒的结构示意图,下列说法正确的是( )
①  ②
②  ③
③ 
A . ①②是同种元素的微粒,且①是阴离子,②是原子
B . ①②是同种元素的微粒,且①是原子,②是阳离子
C . ②③是同种元素的原子
D . ①②属于同种元素的原子
下列叙述正确的是( )
A . Cr原子的电子排布式:ls22s2p63s23p63d4s2
B . Be原子最外层的电子云图:  C . C原子的电子排布图:
C . C原子的电子排布图:  D . 价层电子排布式为2s22p2和3s2p5的两种原子能形成共价化合物
D . 价层电子排布式为2s22p2和3s2p5的两种原子能形成共价化合物
具有下列价电子数的原子,最难形成离子的是( )
A . L层6个
B . L层4个
C . M层2个
D . M层7个
一种由短周期主族元素组成的化合物(如下图所示),常用作氧化剂、漂白剂、消毒剂等,其中 X、Y、Z、W的原子序数依次增大,且 X、Y、Z的原子序数之和与 W的原子序数相等。下列有关叙述错误的是( )

A . 该化合物中 W和 Z的化合价分别为 +6价、-2价
B . W的氢化物具有还原性
C . 该化合物中 Y、Z、W不全满足 8电子稳定结构
D . Y的最高价氧化物的水化物为强酸
T、L、R、Q四种短周期主族元素,原子序数依次增大,T的最外层电子数是内层电子数的3倍;R与T同族,L3+与T2−的核外电子层结构相同。下列说法正确的是( )
A . 氢化物的稳定性为H2T<H2R
B . 化合物LQ3的水溶液呈碱性
C . L与T形成的化合物具有两性
D . R、Q的氧化物对应的水化物均为强酸
冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。
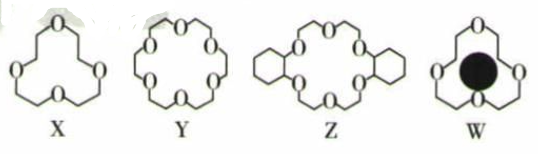
-
(1) Li+与X的空腔大小相近,恰好能进入到X的环内,且Li+与氧原子的一个孤电子对作用形成稳定结构W(如图)。基态锂离子核外能量最高的电子所处电子层符号为。
-
(2) 冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构。理由是 。
-
(3) 烯烃难溶于水,被KMnO4水溶液氧化的效果较差。若烯烃中溶入冠醚Z,氧化效果明显提升。水分子中中心氧原子的杂化轨道的空间结构是 H-O键键角(填“>“<”或“=”)109°28'。
碳是形成许多有机材料和无机非金属材料的重要组成元素。回答下列问题:
-
(1) 基态碳原子的价电子排布式为。
-
(2)
 的沸点比
的沸点比  高的主要原因为。
高的主要原因为。
-
(3) 一种半导体材料,由C、N形成类石墨烯平面结构,通过层层堆叠而成,其晶胞结构如图1,晶胞左侧四边形结构如图2。
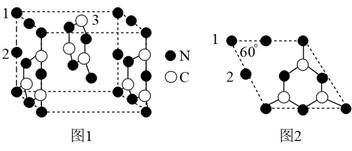
①图1中“3”碳原子不处于晶胞面心的理由为。
②同一层中“1”氮原子和“2”氮原子配位数之比为。
③每个“2”氮原子提供个电子参与形成π键。
④已知该晶胞的体积为Vcm3 , 阿伏加德罗常数的值为
 ,则该品胞的密度为
,则该品胞的密度为 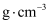 。
。
2021年2月10日,我国自主研发的“天问一号”成功被火星捕获,开始绕火星飞行。“天问一号”的制作材料中包含了 、
、 、C、
、C、 、P等多种元素。回答下列问题:
、P等多种元素。回答下列问题:
 、
、 、C、
、C、 、P等多种元素。回答下列问题:
、P等多种元素。回答下列问题:
-
(1) 碳元素有
 、
、 、
、 等核素,基态
等核素,基态 原子核外有种空间运动状态的电子,
原子核外有种空间运动状态的电子, 原子价电子轨道表达式为。
原子价电子轨道表达式为。
-
(2) 铁与氨气在高温时可发生置换反应,产物之一的晶胞结构如图所示,则该反应的化学方程式为:,反应中所涉及元素基态原子的第一电离能由大到小的顺序是;
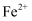 具有较强的还原性,原因是。
具有较强的还原性,原因是。
-
(3) 与
 同周期的所有元素的基态原子中,未成对电子数与
同周期的所有元素的基态原子中,未成对电子数与 相同的元素有(填元素符号)。
相同的元素有(填元素符号)。
-
(4) 碳元素的单质有多种形式,其中石墨的结构如下图,则石墨晶体中含有的六边形个数与
 键数目之比为。建立如下图的原子坐标系,原子A的分数坐标为
键数目之比为。建立如下图的原子坐标系,原子A的分数坐标为 , C的分数坐标为
, C的分数坐标为 , 则B的分数坐标为。
, 则B的分数坐标为。
最近合成的一种铁基超导材料CaxFeyAsz(相对分子质量为M),在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:

-
(1) 基态As原子价电子排布式为。
-
(2) As、Fe、Ca电负性由大到小的顺序为。FeCl3的沸点(319℃)高于AsCl3的沸点(130.2℃),原因是。
-
(3) 该材料的化学式为,已知:体心的Ca原子与顶点的Ca原子有着相同的化学环境(化学环境受周围粒子的数目与距离所影响),该晶胞的晶胞参数为apm、apm、cpm,晶胞中As原子1和As原子2的分数坐标分别为、。
-
(4) 设阿伏加德罗常数为NA , 则该晶体的密度为g·cm-3(用含M的代数式表示)。
下列有关化学用语表示正确的是( )
A . NaClO的电子式: B . C原子的一种激发态:
B . C原子的一种激发态: C .
C .  的结构示意图:
的结构示意图: D .
D .  的基态电子排布式:
的基态电子排布式:
 的结构示意图:
的结构示意图: D .
D .  的基态电子排布式:
的基态电子排布式:
含镍、铜的物质在生产生活中有着广泛应用。回答下列问题:
-
(1) 基态Ni的价电子排布图为。
-
(2) 元素Cu与Ni的第二电离能(I2分别为1959kJ·mol-1、1753kJ·mol-1 , I2(Ni)<I2(Cu)的原因是。
-
(3) Cu2O和Cu2S都是离子晶体,熔点较高的是。
-
(4) Cu可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4 , 其阴离子的空间构型是,加热该物质时,首先失去的是H2O分子,原因是。
-
(5) 甲基丙烯酸铜是一种重要的有机铜试剂,其结构为
 。此有机铜试剂中,与氧原子相连的碳原子的杂化轨道类型为,1mol此有机铜试剂中含有σ键的物质的量为mol。
。此有机铜试剂中,与氧原子相连的碳原子的杂化轨道类型为,1mol此有机铜试剂中含有σ键的物质的量为mol。
-
(6) 四方晶系的CuFeS2晶胞结构如图所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图中原子1的坐标为(
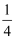 ,
, 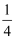 ,
,  ),则原子2的坐标为。晶体中距离Fe最近的S有个。
),则原子2的坐标为。晶体中距离Fe最近的S有个。②设阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3(列出计算式即可)。
最近更新



