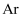离子晶体 知识点题库
三种晶体熔点由高到低的顺序是。
(2)下列六种晶体:①CO2、②NaCl、③Na、④Si、⑤CS2、⑥金刚石,它们的熔点从低到高的顺序为(填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有,由非极性键形成的非极性分子有,
能形成分子晶体的物质是,含有氢键的晶体的化学式是,属于离子晶体的是,
属于原子晶体的是,五种物质的熔点由高到低的顺序是。
NaCl | MgCl2 | CaCl2 | SiCl4 | |
熔点(℃) | 801 | 712 | 782 | ﹣68 |
沸点(℃) | 1 465 | 1 412 | 1 600 | 57.6 |
则下列各项表述与表中数据一致的有( )
①CaCl2属于离子晶体 ②SiCl4是分子晶体
③1500℃时,NaCl可气化 ④MgCl2水溶液不能导电.
A.固态时能导电,能溶于盐酸
B.能溶于CS2 , 不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A. ;B. ;C. ;D.
①C60 ②NaOH ③H2O2 ④Na2O2 ⑤NH4Cl⑥CO2 ⑦C2H2 ⑧SiO2⑨晶体氖 ⑩铁
(1)属于分子晶体的是
(2)属于原子晶体的是
(3)属于离子晶体的是
(4)固体可以导电的晶体是
(5)含有极性共价键的非极性分子是

-
(1) 氧、硫、硒三元素的第一电离能由大到小的顺序为(用元素符号回答)。
-
(2) 基态Se原子的价层电子排布式为,其原子核外有种运动状态不同的电子。
-
(3) 气态SO3为单分子状态,其中S原子的杂化轨道类型为。若SO3的三聚体(SO3)3的环状结构如图所示,则该结构中S原子的杂化轨道类型为。

-
(4) 氧族元素的气态氢化物中,H2S的稳定性强于H2Se,原因是。
-
(5) 氧、硫分别与钙形成两种化合物的晶格能大小为 CaO CaS (填“>”,“<”或“=”)。
-
(6) 硫化锌在光导材料、涂料等行业中应用广泛,其晶体结构如图,则该晶体属于晶体,化学式为,若晶体的密度为ρg·cm-3 , 则晶胞边长为cm (阿伏加德罗常数的值用NA表示)。

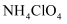 )等。制备
)等。制备 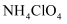 的工艺流程如下:
的工艺流程如下: 饱和食盐水  粗品下列说法错误的是( )
粗品下列说法错误的是( )
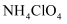 属于离子化合物
B . 该条件下溶解度:
属于离子化合物
B . 该条件下溶解度:  C . 电解
C . 电解 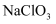 溶解时阳极反应式为
溶解时阳极反应式为  D . 该流程中可循环利用的物质是
D . 该流程中可循环利用的物质是 
-
(1) 下列关于CaF2的表述正确的是。
a.F-的离子半径小于Cl- , 则CaF2的熔点高于CaCl2
b.Ca2+与F-间仅存在静电吸引作用
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
-
(2) CaF2难溶于水,但可溶于含Al3+的溶液中,原因是(用离子方程式表示)。 已知AlF63-在溶液中可稳定存在。
-
(3) F2通入稀NaOH溶液中可生成OF2 , OF2分子构型为,其中氧原子的杂化方式为。
-
(4) F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1 , F-F键键能为159kJ·mol-1 , Cl-Cl键键能为242kJ·mol-1 , 则ClF3中Cl-F键的平均键能为kJ·mol-1。ClF3的熔、沸点比BrF3的(填“高”或“低”)。
-
(1)
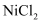 呈黄色,其中
呈黄色,其中 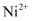 的价电子轨道表示式为。
的价电子轨道表示式为。
-
(2)
 呈绿色,晶体结构与氯化钠类似,每个
呈绿色,晶体结构与氯化钠类似,每个 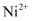 周围有个最近距离的
周围有个最近距离的  。
。
-
(3)
 是一种无色挥发性液体,沸点为
是一种无色挥发性液体,沸点为  ,熔点为
,熔点为  。
。 ①它形成的晶体类型为。
②配体
 中
中 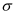 键和
键和  键的个数比为。
键的个数比为。 -
(4) 丁二酮肟镍呈鲜红色,其结构如下图。

①分子中第二周期元素的第一电离能由大到小的顺序为。
②丁二酮肟镍分子中存在的化学键有。
A.共价键 B.氢键 C.离子键 D.金属键 E.配位键
| 离子晶体 | 共价晶体 | 分子晶体 | |
| A | 苏打 | 金刚砂 | 干冰 |
| B | 玻璃 | | 硫磺 |
| C | | 石墨 | 冰醋酸 |
| D | 胆矾 | 金刚石 | |
-
(1) 图甲是某离子化合物的晶胞,阳离子位于体心,阴离子位于8个顶点,该化合物中阳、阴离子的个数比是。
-
(2) 若Ca、Ti、O形成的某钙钛矿型晶体的晶胞结构如图乙所示,其化学式为。
-
(3) 共价晶体硼的基本结构单元是由硼原子组成的正二十面体,如图丙。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。观察该晶胞,推断这个基本结构单元所含硼原子的个数、键角、B-B键的个数依次为、 、。
-
(4) 如图丁所示的物质结构中最外层已达8电子稳定结构的原子是(填元素符号),H3BO3晶体中B原子与极性键的个数比为。
-
(5) 金属铜具有很好的延展性传热性以及导电性,解释此现象最简单的理论是。
 晶体的结构模型如图所示,下列说法正确的是( )
晶体的结构模型如图所示,下列说法正确的是( ) 
 晶体中与每个
晶体中与每个  最邻近的
最邻近的  有12个(如图是其晶胞结构模型)
C .
有12个(如图是其晶胞结构模型)
C . 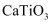 的摩尔质量为136
D . 在晶体中只要有阳离子就一定有阴离子
的摩尔质量为136
D . 在晶体中只要有阳离子就一定有阴离子
 立方晶胞结构,图2为
立方晶胞结构,图2为 结构,图3为
结构,图3为 晶胞结构。
晶胞结构。
下列说法错误的是( )
 晶胞中,
晶胞中, 的配位数是8
B .
的配位数是8
B .  晶胞中,
晶胞中, 与H之间的最短距离为
与H之间的最短距离为 C .
C .  中存在离子键、配位键和共价键
D . 1个
中存在离子键、配位键和共价键
D . 1个 晶胞中含有2个钠原子
晶胞中含有2个钠原子