离子晶体 知识点题库
下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
A . 食盐和葡萄糖分别溶解在水中
B . 干冰和氯化铵分别受热变为气体
C . 二氧化硅和铁分别受热熔化
D . 液溴和苯分别受热变为气体
下列性质适合于离子晶体的是( )
A . 熔点﹣218℃,难溶于水
B . 熔点3 900℃,硬度很大,不导电
C . 难溶于水,固体时导电,升温时导电能力减弱
D . 难溶于水,熔点高,固体不导电,熔化时导电
NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiOFeO(填“<”或“>”).
下列说法中错误的是( )
A . 离子晶体在熔化状态下能导电
B . 在晶体中只要有阴离子就一定有阳离子
C . 原子晶体中一定有非极性共价键
D . 分子晶体中不一定含有共价键
下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列
⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定
⑦干冰晶体中,一个CO2分子周围有12个CO2分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6.
A . ①②③
B . ②③④
C . ④⑤⑥
D . ②③⑦
有下列几种晶体:
A.SiC B.CO2 C.水晶 D.白磷 E.晶体氩 F.氯化铵 G.金刚石 H.铁
-
(1) 其中经常用作玻璃刀刀头的是
-
(2) 属于原子晶体的化合物是
-
(3) 含有共价键的离子晶体是
-
(4) 受热熔化后化学键不发生变化的是
-
(5) 熔融状态下能导电的是.
下列说法中正确的是( )
A . 晶体中分子间作用力越大分子越稳定
B . 原子晶体中共价键越强熔点越高
C . 冰融化时水分子中共价键发生断裂
D . 氢氧化钠熔化时离子键、共价键均被破坏
下列各组物质中,按熔点由低到高的顺序排列正确的是( )
①O2、I2、Hg ②CO、KCl、SiO2 ③Na、K、Rb ④Na、Mg、Al
A . ①③
B . ①④
C . ②③
D . ②④
原子序数依次增大的A,B,C,D,E,F五种元素的原子位于前四周期,A元素原子核外有三种不同能级且各个能级所填充的电子数相同,C原子的核外已成对的电子数是未成对电子数的3倍;D核内质子数比E少1;E与C同主族;F2+的M能层里电子全满。
-
(1) B元素的名称为,F元素基态原子的价电子排布式为。
-
(2) 元素A、B、C第一电离能顺序为(填元素符号)。
-
(3) C与E分别形成的最简单氢化物沸点高低顺序为(用化学式表示),原因是。
-
(4) D与溴形成的化合物DBr5 , 加压条件下95℃液化,发生完全电离得到一种能够导电的液体,经测定,该熔体中含有一种正四面体结构的阳离子和Br- , 请写出该条件下DBr5电离的电离方程式。该熔体中阳离子的中心原子的杂化方式为。
-
(5) 请写出E的两种常见氧化物的分子空间构型:,。

-
(6) F与E形成的离子晶体晶胞如图所示,该晶体的化学式为(用元素符号表示);若晶体的密度为ρ g/cm3 , 则该晶胞的棱长为pm。
萤石(CaF2)属于立方晶体,晶体中每个Ca2+被8个F-包围,则晶体中F-的配位数为( )
A . 2
B . 4
C . 6 .
D . 8
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价,如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是 ( )

A . 超氧化钾的化学式为KO2 , 每个晶胞含有4个K+和4个  B . 晶体中每个K+周围有8个
B . 晶体中每个K+周围有8个  ,每个
,每个  周围有8个K+
C . 晶体中与每个K+距离最近的K+有8个,晶体中与每个
周围有8个K+
C . 晶体中与每个K+距离最近的K+有8个,晶体中与每个  距离最近的
距离最近的  有6个
D . 晶体中其中0价氧和-2价氧的物质的量之比为1:1
有6个
D . 晶体中其中0价氧和-2价氧的物质的量之比为1:1
 B . 晶体中每个K+周围有8个
B . 晶体中每个K+周围有8个  ,每个
,每个  周围有8个K+
C . 晶体中与每个K+距离最近的K+有8个,晶体中与每个
周围有8个K+
C . 晶体中与每个K+距离最近的K+有8个,晶体中与每个  距离最近的
距离最近的  有6个
D . 晶体中其中0价氧和-2价氧的物质的量之比为1:1
有6个
D . 晶体中其中0价氧和-2价氧的物质的量之比为1:1
硫代硫酸钠(Na2S2O3)可作定影剂,反应的化学方程式为AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr,产物中的Na3[Ag(S2O3)2]常用于切花保鲜。下列说法错误的是( )
A . 基态Na+的核外电子存在10种运动状态
B . S2O  的空间结构为四面体形,中心原子S的杂化方式为sp3
C . 欲测定切花保鲜液中Na3[Ag(S2O3)2]的浓度,可用NaCl标准溶液滴定Ag+
D . NaBr的晶体结构与NaCl晶体相似,每个Br-周围有8个Na+
的空间结构为四面体形,中心原子S的杂化方式为sp3
C . 欲测定切花保鲜液中Na3[Ag(S2O3)2]的浓度,可用NaCl标准溶液滴定Ag+
D . NaBr的晶体结构与NaCl晶体相似,每个Br-周围有8个Na+
 的空间结构为四面体形,中心原子S的杂化方式为sp3
C . 欲测定切花保鲜液中Na3[Ag(S2O3)2]的浓度,可用NaCl标准溶液滴定Ag+
D . NaBr的晶体结构与NaCl晶体相似,每个Br-周围有8个Na+
的空间结构为四面体形,中心原子S的杂化方式为sp3
C . 欲测定切花保鲜液中Na3[Ag(S2O3)2]的浓度,可用NaCl标准溶液滴定Ag+
D . NaBr的晶体结构与NaCl晶体相似,每个Br-周围有8个Na+
下图是从NaCl或CsCl晶体结构中分割出来的部分结构示意图,试判断属于NaCl晶体结构的是( )

A . a和c
B . b和c
C . a和d
D . 只有a
下列有关晶体的叙述符合题意且前后叙述有因果关系的是( )
A .  晶体熔点高、硬度大;
晶体熔点高、硬度大;  晶体可用于制造光导纤维
B . 碘晶体中的I-I键能较小;晶体碘沸点低、易升华
C . 在金刚石和硅晶体中,原子间通过共价键形成空间网状结构;金刚石和硅晶体类型相同
D . NaCl晶体中
晶体可用于制造光导纤维
B . 碘晶体中的I-I键能较小;晶体碘沸点低、易升华
C . 在金刚石和硅晶体中,原子间通过共价键形成空间网状结构;金刚石和硅晶体类型相同
D . NaCl晶体中  与
与  个数比为1:1,CsCl晶体中
个数比为1:1,CsCl晶体中  与
与  个数比也为1∶1,NaCl和CsCl的晶胞结构相同
个数比也为1∶1,NaCl和CsCl的晶胞结构相同
 晶体熔点高、硬度大;
晶体熔点高、硬度大;  晶体可用于制造光导纤维
B . 碘晶体中的I-I键能较小;晶体碘沸点低、易升华
C . 在金刚石和硅晶体中,原子间通过共价键形成空间网状结构;金刚石和硅晶体类型相同
D . NaCl晶体中
晶体可用于制造光导纤维
B . 碘晶体中的I-I键能较小;晶体碘沸点低、易升华
C . 在金刚石和硅晶体中,原子间通过共价键形成空间网状结构;金刚石和硅晶体类型相同
D . NaCl晶体中  与
与  个数比为1:1,CsCl晶体中
个数比为1:1,CsCl晶体中  与
与  个数比也为1∶1,NaCl和CsCl的晶胞结构相同
个数比也为1∶1,NaCl和CsCl的晶胞结构相同
下列各项叙述中,正确的是( )
A . H2O、H2S、H2Se由于分子间作用力依次增大,所以熔、沸点依次升高
B . 邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点高
C . 配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18时,n=5
D . 由第ⅠA族和第ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有极性共价键的离子化合物
二氧化碳经常用来灭火,但金属镁能够在二氧化碳中燃烧:2Mg+CO2  =2MgO+C,下列关于该反应中涉及物质的说法错误的是( )
=2MgO+C,下列关于该反应中涉及物质的说法错误的是( )
 =2MgO+C,下列关于该反应中涉及物质的说法错误的是( )
=2MgO+C,下列关于该反应中涉及物质的说法错误的是( )
A . Mg属于金属晶体
B . 干冰中一个CO2分子周围有4个紧邻的分子
C . MgO熔点高,可以用作耐高温材料
D . 金刚石和石墨互为同素异形体,二者C的杂化方式和晶体类型都不同
下列有关化学用语正确的是( )
A . 基态氮原子的电子排布图: B . 如图是食盐晶体的晶胞:
B . 如图是食盐晶体的晶胞: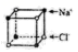 C . NH4Br的电子式:
C . NH4Br的电子式: D . CCl4分子的比例模型:
D . CCl4分子的比例模型:
 C . NH4Br的电子式:
C . NH4Br的电子式: D . CCl4分子的比例模型:
D . CCl4分子的比例模型:
有关晶体的结构如图所示,下 列说法中错误的是 ( )
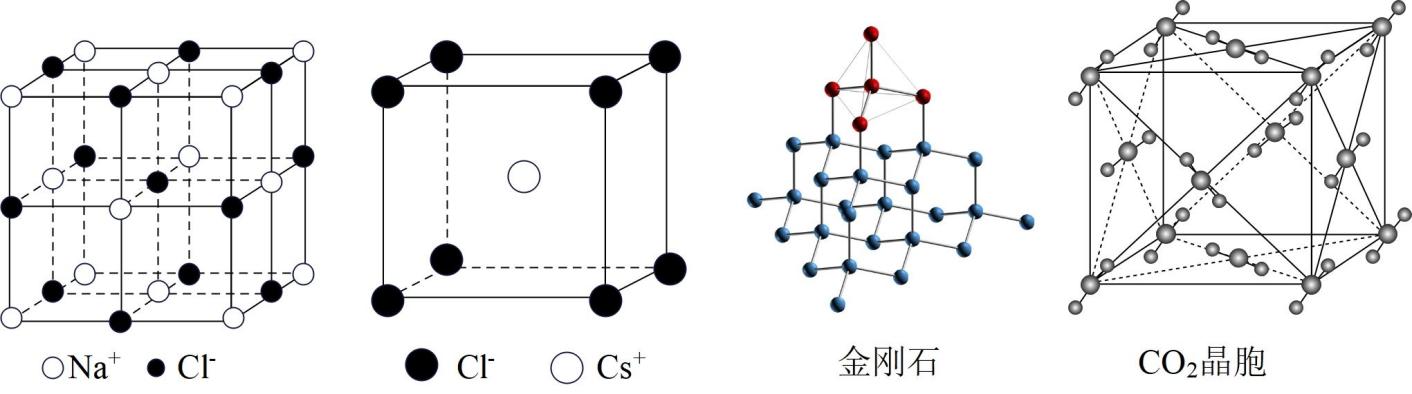
A . 在NaCl晶体中,每个晶胞平均占有4个Cl-
B . 在CsCl晶体中,距Cl-最近的Cs+有6个
C . 在金刚石晶体中,最小的环上有6个C原子
D . CO2 晶胞中一个分子周围有12个紧邻分子
2022年1月12日《自然》公布了我国科学家利用高温超导钇钡铜氧(YBCO)薄膜发现奇异金属。下列有关说法错误的是( )
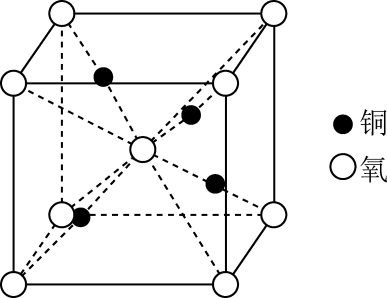
A . 金属晶体由金属离子和自由电子构成
B . 氧化钡(BaO)晶体是离子晶体
C . 基态Cu+的价层电子排布式为 D . 如图所示晶胞代表的晶体的化学式为CuO
D . 如图所示晶胞代表的晶体的化学式为CuO
 D . 如图所示晶胞代表的晶体的化学式为CuO
D . 如图所示晶胞代表的晶体的化学式为CuO
铜的某种氧化物的晶胞结构如图所示。下列说法错误的是( )
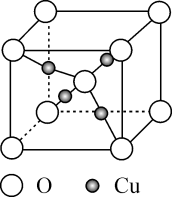
A .  位于元素周期表
位于元素周期表 区
B . 该晶胞中
区
B . 该晶胞中 的配位数为4
C . 该物质的化学式为
的配位数为4
C . 该物质的化学式为 D . O位于
D . O位于 围成的四面体的体心
围成的四面体的体心
 位于元素周期表
位于元素周期表 区
B . 该晶胞中
区
B . 该晶胞中 的配位数为4
C . 该物质的化学式为
的配位数为4
C . 该物质的化学式为 D . O位于
D . O位于 围成的四面体的体心
围成的四面体的体心
最近更新



