离子晶体 知识点题库
①NaCl、②干冰、③冰、④Na2O2、⑤白磷(P4)、⑥金刚石、⑦Na2CO3、⑧钠.以上物质中属于离子晶体的是 ;属于分子晶体的是 (填序号).氯化钡是无色晶体,溶于水,水溶液能导电,熔点1560℃.它可能属于 晶体.
有下列几种晶体,完成下列各小题.
A.干冰 B.氯化钠 C.冰 D.水晶 E.氯化铵 F.晶体氖 G.铝 H.C60 I.金刚石
(1)属于分子晶体的是 ,属于离子晶体的是 .
(2)晶体中有氢键的是 ,受热熔化只需克服共价键的是
对下列物质进行分类(均填序号).
A组:①H2O与H2O2;
②金刚石与水晶;
③CH3CH2OH与CH3OCH3;
④16O和18O;
⑤汞与水银;
⑥12C60与13C70;
B组:①钨; ②固态三氧化硫; ③晶体硅; ④钠; ⑤石英; ⑥氯化钡;⑦硫; ⑧氯化钠.
-
(1) A组中互为同位素的是;互为同素异形体的是;互为同分异构体的是;
-
(2) B组中属于离子晶体,属于分子晶体,原子晶体.
CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22﹣存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )

A . 1 个 Ca2+周围距离最近且等距离的 C22﹣数目为 6
B . 该晶体中的阴离子与F2是等电子体
C . 6.4 g CaC2晶体中含阴离子0.1 mol
D . 与每个Ca2+距离相等且最近的Ca2+共有12个
如图为离子晶体空间构型示意图,则离子晶体的组成表达式不正确的是( )

A . XY
B . XY2Z
C . XY3
D . XY2
某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体中心.试分析:

-
(1) 晶体中每个Y同时吸引着个X,每个X同时吸引着个Y,该晶体的化学式为.
-
(2) 晶体中在每个X周围与它最接近且距离相等的X共有个.
-
(3) 晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为.
离子晶体熔点的高低决定于阴、阳离子之间距离、晶格能的大小,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是( )
A . KCl>NaCl>BaO>CaO
B . NaCl>KCl>CaO>BaO
C . CaO>BaO>KCl>NaCl
D . CaO>BaO>NaCl>KCl
下面有关晶体的叙述中,不正确的是( )
A . 金刚石空间网状结构中,由共价键形成的碳原子环中,最小环上有6个碳原子
B . 氯化钠晶体中,每个Na+周围距离相等的Cl-共有6个
C . 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D . 干冰晶体中,每个CO2分子周围紧邻10个CO2分子
萤石(CaF2)晶体属于立方晶系,萤石中每个Ca2+被8个F-所包围,则每个F-周围最近距离的Ca2+数目为( )
A . 2
B . 4
C . 6
D . 8
下列关于晶体的说法中,正确的是( )
A . SiO2晶体中每个硅原子与两个氧原子以共价键相结合
B . NaCl晶体中每个Na+周围同时吸引6个Cl-
C . 干冰晶体中每个CO2分子周围与它距离最近且等距的CO2分子有12个
D . 共价键可决定分子晶体的熔、沸点
下列有关离子晶体的数据大小比较不正确的是( )
A . 熔点:NaF>MgF2>AlF3
B . 晶格能:NaF>NaCl>NaBr
C . 阴离子的配位数:CsCl>NaCl
D . 硬度:MgO>CaO>BaO
如图是NaCl晶体的一个晶胞的结构模型(黑球为Cl-、白球为Na+)。KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O2-代替,则下列对于KO2晶体结构的描述错误的是( )

A . 与K+距离相等且最近的K+有8个
B . 与K+距离相等且最近的O2-构成的多面体是正八面体
C . 一个KO2晶胞中的K+和O2-粒子数均为4个
D . 与K+距离相等且最近的O2-共有6个
共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体①Na2O2、②SiO2、③石墨、④金刚石、⑤NaCl、⑥白磷中,含有以上其中两种作用力的是( )
A . ①②③
B . ①③⑥
C . ②④⑥
D . ①②③⑥
下列物质所属晶体类型分类正确的是( )
| 选项 | A | B | C | D |
| 原子晶体 | 石墨 | 生石灰 | 碳化硅 | 金刚石 |
| 分子晶体 | 冰 | 固态氨 | 氯化铯 | 干冰 |
| 离子晶体 | 氮化铝 | 食盐 | 明矾 | 芒硝 |
| 金属晶体 | 铜 | 汞 | 铝 | 铁 |
A . A
B . B
C . C
D . D
下列关于晶体的说法中错误的是( )
A . 固态不导电而熔融状态导电的晶体一定是离子晶体
B . 具有正四面体结构的晶体,可能是共价晶体或分子晶体,其键角都是109°28′
C . 熔点是10.31℃,液态不导电,水溶液能导电的晶体一定是分子晶体
D . 金属晶体中一定含有金属键,金属键没有方向性和饱和性
下表各组数据中,一定有错误的是( )
| A | 金刚石硬度:10 | 碳化硅硬度:9 | 晶体硅硬度:7 |
| B | 溴化钾熔点:735℃ | 氯化钠熔点:801℃ | 氧化镁熔点:2800℃ |
| C | 邻羟基苯甲醛沸点:250℃ | 对羟基苯甲醛沸点196℃ | 对甲基苯甲醛沸点:204℃ |
| D | 三氟化硼的键角:120° | 氨分子的键角:120° | 四氯化碳的键角:109.5° |
A . A
B . B
C . C
D . D
Cu2ZnSnS4是太阳能薄膜电池的重要成分,其晶胞结构(棱边夹角均为90°)如图所示,下列说法错误的是( )
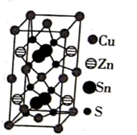
A . 第一电离能:Cu<Zn
B . 1个晶胞中含有Cu2ZnSnS4单元数为2个
C . 距离每个Zn原子最近的S原子数为2个
D . 四种元素基态原子中,核外电子空间运动状态最多的为Sn原子
下列有关晶体的叙述中,正确的是( )
A . 晶体中只要有阳离子就一定有阴离子
B . 金刚石、Si
C . NaF、NaCl、  、
、  晶体的熔点依次降低
晶体的熔点依次降低  周围紧邻且距离相等的
周围紧邻且距离相等的  所形成的结构为正四面体形
所形成的结构为正四面体形
 、
、  晶体的熔点依次降低
晶体的熔点依次降低 C.金刚石的三维骨架结构中,由共价键形成的最小碳环上有4个碳原子
D . 氯化钠晶体中,每个 周围紧邻且距离相等的
周围紧邻且距离相等的  所形成的结构为正四面体形
所形成的结构为正四面体形
如图表示一些晶体中的某些结构,下列各项所述错误的是( )

A . 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B . 干冰晶体中二氧化碳分子的取向不完全相同
C . 氯化铯晶体中,每个Cs+周围距离最近的Cs+个数为8个
D . 在CaF2晶体中,每个晶胞平均占有4个Ca2+
储氢合金LaNi5、LaCo5、CeCo5等结构和CaCu5相同。CaCu5合金由图甲、乙两个原子层交替密堆积而成,丙是CaCu5的晶体结构。

下列说法正确的是( )
A . CaCu5晶体类型为离子晶体
B . 晶体中Ca原子与6个Cu原子配位
C . CaCu5晶体的一个晶胞中Cu原子数为15
D . LaNi5晶胞体积为9×10-23cm-3 , 储氢后形成LaNi5H4.5的合金,氢进入晶胞空隙,体积不变,氢在合金中的密度约为0.083g•cm-3
最近更新



