离子晶体 知识点题库

-
(1) 请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。
-
(2) 晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有个。
-
(3) 在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于,即(填计算式);Na+的个数等于,即(填计算式)。
-
(4) 设NaCl的摩尔质量为Mrg·mol-1 , 食盐晶体的密度为ρg·cm-3 , 阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为cm。
请回答:
-
(1) “氯盐类”融雪剂主要成分的晶体类型为
-
(2) 冰比硫化氢熔点高的原因是 ,冰分子中氧原子的杂化轨道
类型为 ;水的密度在4℃最大的原因是
-
(3) 已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ•mol﹣1
I1
I2
I3
I4
X
578
1817
2745
11578
Y
738
1451
7733
10540
Z
496
4562
6912
9543
元素Y第一电离能大于X的原因是
-
(4) 已知CN﹣与 N2结构相似,1mol CN﹣中π键数目为
| 离子晶体 | 原子晶体 | 分子晶体 | |
| A | NaOH | Ar | SO2 |
| B | H2SO4 | 石墨 | S |
| C | CH3COONa | 水晶 | |
| D | Ba(OH)2 | 金刚石 | 玻璃 |
-
(1) NaH的熔点为800℃,不溶于有机溶剂。NaH属于晶体,其电子式为。
-
(2) AlCl3可作净水剂,其理由是(用必要的化学用语和相关文字说明)。

|
A组 |
B组 |
C组 |
D组 |
|
金刚石:3550 ℃ |
Li:181 ℃ |
HF:-83 ℃ |
NaCl:801 ℃ |
|
硅晶体:1410 ℃ |
Na:98 ℃ |
HCl:-115 ℃ |
KCl:776 ℃ |
|
硼晶体:2300 ℃ |
K:64 ℃ |
HBr:-89 ℃ |
RbCl:718 ℃ |
|
二氧化硅:1723 ℃ |
Rb:39 ℃ |
HI:-51 ℃ |
CsCl:645 ℃ |
据此回答下列问题:
-
(1) A组属于晶体。
-
(2) B组晶体共同的物理性质是(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
-
(3) C组中HF熔点反常是由于。
-
(4) D组晶体可能具有的性质是(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
-
(5) D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为。

-
(1) 银位于元素周期表第五周期第IB族元素,其价电子排布式为。
-
(2) 金(Au)溶于王水的原理是金与强氧化性的硝酸生成微量的Au3+和NO,盐酸提供的Cl-与Au3+形成[AuCl4]-配离子,写出总反应的离子方程式:。
-
(3) [Au80Ag30(
 )42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是。
)42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是。
-
(4) 第三周期部分主族元素的氟化物的熔点(见表)
化合物
NaF
AlF3
SiF4
SF6
熔点/℃
993
1040
-90
-50.5
由表中数值可以判断AlF3晶体类型为,SiF4比SF6熔点低的原因;SF6分子的空间构型为正八面体,如图所示,它的二氯代物SF4Cl2有种。
-
(5) 固态五氯化磷为离子晶体,结构单元可以写作PCl
 、PCl
、PCl  ,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:若密度为d g/cm3 , 则晶胞参数a=pm(已知阿伏加德罗常数的值为NA , 列出计算式即可)。
,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:若密度为d g/cm3 , 则晶胞参数a=pm(已知阿伏加德罗常数的值为NA , 列出计算式即可)。 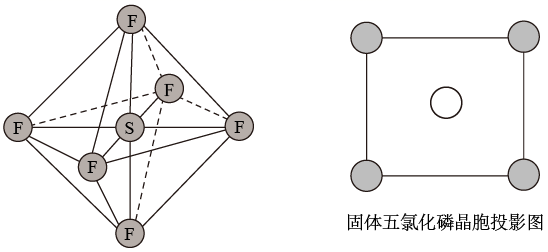
-
(1) 金属可导电、导热,有金属光泽和延展性,这些性质都可以用“理论”解释。
-
(2) 已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合(选填编号),每个Mn原子周围紧邻的原子数为。
A.
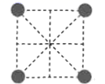 B.
B.  C.
C.  D.
D. 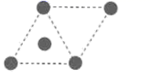
-
(3) 无水CoCl2的熔点是735℃,沸点1049℃,CoCl2属于晶体;砷酸
 分子中As原子的杂化方式为杂化。
分子中As原子的杂化方式为杂化。
-
(4) 碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,
 分子占据顶点和面心处,
分子占据顶点和面心处,  占据的是
占据的是  分子围成的正四面体空隙和空隙(填几何空间构型)。
分子围成的正四面体空隙和空隙(填几何空间构型)。 
-
(5) Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+ , 则晶体中Ni2+与Ni3+的最简整数比为,晶胞参数为428pm,则晶体密度为g/cm3(
 表示阿伏加德罗常数的值,列出表达式)
表示阿伏加德罗常数的值,列出表达式)
-
(1) 钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态Ti原子价电子排布式为。
②Fe元素在元素周期表中的位置是。
-
(2) 制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序为(用元素符号表示)。
②COCl2分子中所有原子均满足8电子稳定结构,COCl2分子中π键和σ键的个数比为,中心原子的杂化方式为。
-
(3) NiO、FeO的晶体结构均与NaCl的晶体结构相似,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm。则熔点:FeO(填“>"“<” 或“=")NiO。
-
(4) Ni和La的合金是目前使用广泛的储氢材料,具有大容量高寿命、耐低温等特点,在我国已实现了产业化。该合金的晶胞结构如图所示。
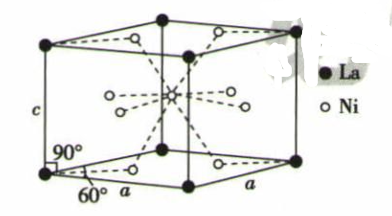
①该晶体的化学式为。
②已知该晶体的摩尔质量为Mg·mol-1 , 密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积为 cm3(用含M、d、N的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c =397 pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力=
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 (结果保留整数)。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 (结果保留整数)。
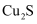 )可以用于制铜,化学反应方程式为
)可以用于制铜,化学反应方程式为 , 制得的粗铜(含
, 制得的粗铜(含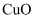 等杂质)可通过电解法进行精炼,下列相关说法正确的是( )
等杂质)可通过电解法进行精炼,下列相关说法正确的是( )
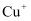 转化为基态
转化为基态 , 得到的电子填充在
, 得到的电子填充在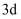 轨道上
B . S元素的电负性大于O元素的电负性
C . 电解精炼铜时,粗铜应与电源的负极相连
D . 如图所示的
轨道上
B . S元素的电负性大于O元素的电负性
C . 电解精炼铜时,粗铜应与电源的负极相连
D . 如图所示的 晶胞中,黑球表示的是
晶胞中,黑球表示的是

 Z pm
D . 其中更稳定的Cu替代型产物的化学式为FeCu3N
Z pm
D . 其中更稳定的Cu替代型产物的化学式为FeCu3N



