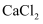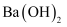离子晶体 知识点题库
下列说法正确的是( )
A . 分子晶体中一定存在分子间作用力,不一定存在共价键
B . 分子中含两个氢原子的酸一定是二元酸
C . 含有金属阳离子的晶体一定是离子晶体
D . 元素的非金属性越强,其单质的活动性一定越强
下图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为acm,氯化铯的相对分子质量为M , NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A .  g/cm3
B .
g/cm3
B .  g/cm3
C .
g/cm3
C .  g/cm3
D .
g/cm3
D .  g/cm3
g/cm3
 g/cm3
B .
g/cm3
B .  g/cm3
C .
g/cm3
C .  g/cm3
D .
g/cm3
D .  g/cm3
g/cm3
用序号填空:
(1)有下列四种物质:①MgCl2晶体 ②干冰 ③NaOH晶体 ④金刚石.
其中只含有离子键的离子晶体是 ;化学式既能表示物质的组成,又能表示物质的一个分子的是 .
(2)在相同条件下,SO2在水中的溶解度和CO2在水中的溶解度相比,SO2的溶解度大,请从分子性质的角度阐述理由 .
(3)有下列四种无机含氧酸:①H2CrO4 ②HMnO4 ③H3AsO4
根据无机含氧酸的酸性规律,将三种无机含氧酸按酸性由强到弱的顺序是
关于晶体的下列说法正确的是( )
A . 在晶体中只要有阴离子,就一定有阳离子
B . 在晶体中只要有阳离子,就一定有阴离子
C . 原子晶体的熔点一定比金属晶体的高
D . 分子晶体的熔点一定比金属晶体的高
在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有(填化学式,下同),由非极性键形成的非极性分子有,能形成分子晶体的物质是,晶体中含有氢键的是,属于离子晶体的是,属于原子晶体的是,五种物质的熔点由高到低的顺序是.
1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖,其晶胞结构如图。

-
(1) 根据图示晶胞结构,推算晶体中Y、Cu、Ba和O原子个数比,确定其化学式。
-
(2) 根据(1)所推出的化合物的组成,计算其中Cu原子的平均化合价(该化合物中各元素的化合价为
 、
、  、
、  和
和  ),试计算化合物中这两种价态Cu原子个数比。
),试计算化合物中这两种价态Cu原子个数比。
下列物质中属于含有非极性键的离子晶体是 ( )
①醋酸钠 ②氢氧化钾 ③过氧化钠 ④金刚石
⑤乙醇 ⑥碳化钙
A . ①②③⑥
B . ①③⑥
C . ①③④⑤
D . ①②⑥
元素a、b、c、d、e为前20号主族元素,原子序数依次增大。b元素原子最外层电子数与核外电子总数之比为2:3;c的氢化物能与其最高价氧化物对应的水化物反应生成一种盐;a与b、c均可以形成电子总数为10的分子;d元素的氧化物能使品红溶液褪色,且加热后品红颜色复原;e原子是前20号主族元素中原子半径最大的。请回答:
-
(1) e元素在周期表中的位置。
-
(2) bd2的电子式;e2d的电子式;ca3的空间构型。
-
(3) e的最高价氧化物的水化物所含化学键类型为、,晶体类型为。其溶液与b的最高价氧化物反应的离子方程式为。
-
(4) 在常温常压下,1g b的最简单气态氢化物完全燃烧放出的热量约为56kJ,写出该反应的热化学方程式。
下列说法不正确的是( )
A . 硅晶体和二氧化硅晶体中都含共价键
B . 冰和干冰熔化时克服的作用力均为分子间作用力
C . 硫晶体和硫酸钠晶体均属于离子晶体
D . 氯气和四氯化碳分子中每个原子的最外电子层都形成了具有8个电子的稳定结构
下面有关晶体的叙述中,错误的是( )
A . 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B . 氯化钠晶体中,每个Na+周围距离相等且紧邻的Na+共有6个
C . 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D . 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
下列关于晶体的说法中,错误的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
⑤晶胞是晶体结构的基本单元
⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定
⑦CsCl和NaCl晶体中阴、阳离子的配位数都为6
A . ①②③
B . ②③④
C . ④⑤⑥
D . ②③⑦
下列有关晶体的叙述中错误的是( )
A . 石墨的层状结构中碳碳键键长比金刚石中碳碳键键长短
B . 氯化钠晶体中每个 Na+周围紧邻的有6个Cl-
C . CsCl 晶体中,与每个 Cs+周围紧邻的有 8 个Cl-和 8 个 Cs+
D . 在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有 12 个金属原子
下列晶体的分类正确的一组是( )
|
选项 |
离子晶体 |
共价晶体 |
分子晶体 |
金属晶体 |
|
A |
|
石墨 |
Ar |
Hg |
|
B |
|
金刚石 |
|
Ag |
|
C |
|
SiC |
|
Mg |
|
D |
|
Si |
|
NaH |
A . A
B . B
C . C
D . D
下列关于离子晶体的说法正确的是( )
A . 形成离子晶体的阴、阳离子之间只存在静电引力
B . 阴、阳离子的配位数只与阴、阳离子的电荷比有关
C . 离子化合物的熔点一定比共价化合物的熔点高
D . 熔融状态下离子键被破坏,使离子自由移动从而导电
下列说法中正确的是( )
A . 在晶体中有阳离子不一定有阴离子
B . 硫单质熔点高于白磷的原因是S-S键键能大于P-P键键能
C . 离子晶体中可能存在共价键,而分子晶体中肯定存在共价键
D . 对于组成和结构相似的分子晶体,相对分子质量越大,熔、沸点一定越高
类推是化学学习和研究中常用的思维方法,下列类推正确的是( )
A . H2O2的热稳定性比H2O的弱,则C2H6的热稳定性比CH4的弱
B . 晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子
C . Mg—Al原电池,Mg的活泼性比Al强,在稀硫酸介质中,Mg做负极,则在稀氢氧化钠介质中,也是Mg做负极
D . 根据反应Fe(OH)3+3HCl=FeCl3+3H2O,可类推反应Fe(OH)3+3HI=FeI3+3H2O
钴的一种化合物的晶胞结构如图所示,下列说法错误的是( )
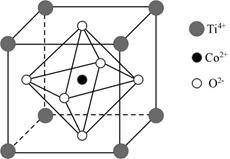
A . 元素钛在元素周期表中的位置为第四周期ⅣB族
B . 基态  的核外电子排布式为
的核外电子排布式为 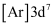 C . 该化合物的化学式为
C . 该化合物的化学式为 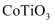 D . 与
D . 与  距离最近的
距离最近的  有4个
有4个
 的核外电子排布式为
的核外电子排布式为 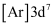 C . 该化合物的化学式为
C . 该化合物的化学式为 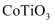 D . 与
D . 与  距离最近的
距离最近的  有4个
有4个
冰晶石是一种在自然界存在的矿物(化学式为 ),熔点
),熔点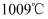 , 如图所示为冰晶石的晶胞。图中“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心。则下列说法错误的是( )
, 如图所示为冰晶石的晶胞。图中“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心。则下列说法错误的是( )
 ),熔点
),熔点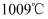 , 如图所示为冰晶石的晶胞。图中“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心。则下列说法错误的是( )
, 如图所示为冰晶石的晶胞。图中“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点和8个小立方体的体心。则下列说法错误的是( )
A . 冰晶石的名称是六氟合铝酸钠
B . 该物质中存在离子键和共价键
C . 大立方体的体心处“△”代表的是 D . 该物质是工业电解氧化铝制取金属铝的助熔剂
D . 该物质是工业电解氧化铝制取金属铝的助熔剂
 D . 该物质是工业电解氧化铝制取金属铝的助熔剂
D . 该物质是工业电解氧化铝制取金属铝的助熔剂
下列叙述中正确的是( )
A . 在 中,Cu为配位原子,NH3为配体
B . 冰分子内氢氧原子间以共价键形成的晶体中,每个水分子周围有4个紧邻的水分子
C . HI的相对分子质量大于HF,所以HI的沸点高于HF
D . CaO2和CaH2均是含有共价键的离子晶体
中,Cu为配位原子,NH3为配体
B . 冰分子内氢氧原子间以共价键形成的晶体中,每个水分子周围有4个紧邻的水分子
C . HI的相对分子质量大于HF,所以HI的沸点高于HF
D . CaO2和CaH2均是含有共价键的离子晶体
 中,Cu为配位原子,NH3为配体
B . 冰分子内氢氧原子间以共价键形成的晶体中,每个水分子周围有4个紧邻的水分子
C . HI的相对分子质量大于HF,所以HI的沸点高于HF
D . CaO2和CaH2均是含有共价键的离子晶体
中,Cu为配位原子,NH3为配体
B . 冰分子内氢氧原子间以共价键形成的晶体中,每个水分子周围有4个紧邻的水分子
C . HI的相对分子质量大于HF,所以HI的沸点高于HF
D . CaO2和CaH2均是含有共价键的离子晶体
下列有关物质结构与性质的叙述正确的是( )
A . 等离子体是只由离子组成的具有带电性的气态物质
B . 1molCo3+的八面体配合物[CoClx(NH3)y]Clz与足量AgNO3溶液作用生成2molAgCl沉淀,则x、y、z的值分别为2、4、2
C . 若MgO的化学键中离子键的百分数为50%,则MgO可看作离子晶体与共价晶体之间的过渡晶体
D . 利用超分子的自组装特征,可以分离C60和C70
最近更新