共价键的形成及共价键的主要类型 知识点题库
下列物质中含有化学键类型完全相同的是( )
A . NaCl、HCl、H2O、NaOH
B . Cl2、Na2S、HCl、SO2
C . HBr、CO2、H2O、CS2
D . Na2O2、H2O2、H2O、O3
天然气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体.下列有关说法不正确的是( )
A . 甲烷与丙烷互为同系物
B . 甲烷的一氯代物只有一种结构证明甲烷是正四面体结构而非平面正方形结构
C . 甲烷、乙烷、丙烷中的化学键都是极性共价键
D . 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃
关于下列反应,说法正确的是:(图中共有三种原子)( ) 

A . 反应过程中E中共价键断裂,G中共价键保持不动
B . E中存在非极性键
C . M分子有可能是HCl
D . 上述反应的类型是加成反应
下列有关叙述中正确的是( )
A . 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
B . 由碳、氮原子形成的化合物比金刚石硬,其主要原因是碳氮键比碳碳键更短
C . S8和NO2都是共价化合物,NH4Cl和CaC2都是离子化合物
D . 若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+10
厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中错误的是( )

A . 1mol NH4+ 所含的质子总数为10NA
B . 联氨(N2H4)中含有极性键和非极性键
C . 过程II属于氧化反应,过程IV属于还原反应
D . 过程I中,参与反应的NH4+与NH2OH的物质的量之比为1:1
金属铁、铜及其化合物在科学研究和工业生产中具有重要的用途。下图1表示铜与氯形成化合物A的晶胞(黑球代表铜原子)。图2是Fe3+与乙酰乙酸乙酯形成的配离子B。

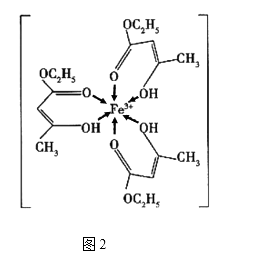
回答下列问题
-
(1) 基态Cu原子的核外电子排布式为。
-
(2) 从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)I1(Cu)(填“>“<”或“=”)
-
(3) 化合物A的化学式为,Cl原子的配位数是。
-
(4) B中碳原子的杂化轨道类型为,含有的化学键为(填字母)。
a.离子键 b.金属键 c.极性键 d.非极性键 e.配位键 f.氢键 g.σ键 h.π键
-
(5) 化合物A难溶于水,但易溶于氨水,其原因可能是;与NH3互为等电子体的分子有(写化学式,一种即可)。NH3的键角大于H2O的键角的主要原因是。
-
(6) 已知化合物A晶体的密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则该晶体中两个Cu原子之间的最短距离为nm(列出计算表达式即可)。
下列说法正确的是( )
①离子化合物含离子键,也可能含极性键或非极性键 ②H2SO3的酸性>H2CO3的酸性,所以非金属性S>C ③含金属元素的化合物不一定是离子化合物 ④由非金属元素组成的化合物一定是共价化合物 ⑤熔融状态能导电的化合物是离子化合物 ⑥由分子组成的物质中一定存在共价键
A . ①③⑤
B . ②④⑥
C . ①②③⑤
D . ①③⑤⑥
下列说法中正确的是( )
A . HCl中存在离子键,属于离子化合物
B . 由非金属元素组成的化合物一定是共价化合物
C . 熔融状态下能导电的化合物一定是离子化合物
D . 阴、阳离子间通过静电引力而形成的化学键叫做离子键
下列说法正确的是( )
A . 在分子中,两个成键的原子间的距离叫做键长
B . H—Cl的键能为431.8 kJ/mol,H—I的键能为298.7 kJ/mol,这可以说明HCl分子比HI分子稳定
C . 含有极性键的分子一定是极性分子
D . 键能越大,表示该分子越容易受热分解
下列物质中,既含有离子键,又含有非极性键的是( )。
A . NaOH
B . Na2O2
C . MgCl2
D . H2O
下列物质:①Ar ②Na2O2 ③CCl4 ④HClO ⑤N2 ⑥MgF2 ⑦NH4Cl
-
(1) 只存在共价键的是,离子化合物有
-
(2) N2的结构式为Na2O2的电子式为
-
(3) 用电子式表示MgF2的形成过程
下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。

-
(1) b、i、m三种元素的简单离子半径由大到小的顺序是(填离子符号)。
-
(2) c、d、m三种元素最高价氧化物对应水化物的碱性由弱到强的顺序是(填水化物的化学式);b、f、h三种元素对应简单氢化物的热稳定性由强到弱的顺序是(填化学式)。
-
(3) 利用图示装置可比较a、e、h三种元素的非金属性强弱,则装置中试剂X、Z分别为、(填化学式)。

-
(4) 化学式为
 的化合物属于(填“离子化合物”或“共价化合物”),其中含有化学键的类型为。
的化合物属于(填“离子化合物”或“共价化合物”),其中含有化学键的类型为。
下列有关化学键的叙述正确的是( )
A . 单质分子中均存在化学键
B . 离子化合物中一定含有离子键
C . 非金属元素之间只能形成共价键
D . 含有共价键的化合物一定是共价化合物
某种水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,其立方晶胞嵌入和嵌出Na+过程中,Fe2+与Fe3+含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图所示。
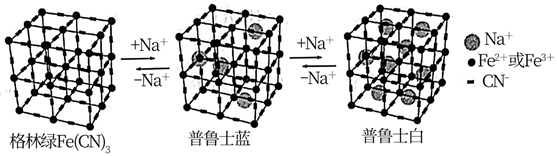 回答下列问题:
回答下列问题:
-
(1) 基态Fe3+价电子轨道表示式是。
-
(2) (CN)2与卤素单质性质相似,与水反应生成HCN,请写出(CN)2的电子式,H、C、N三种元素电负性由大到小的顺序为。
-
(3) HCN中σ键与π键个数比为。已知沸点:
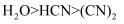 ,解释原因。
,解释原因。
-
(4) 下列微粒中,与HCN具有相同立体构型的是_______(填字母)。A .
 B .
B .  C .
C .  D .
D . 
-
(5) 普鲁士蓝中Fe2+与Fe3+个数比为。已知普鲁士白晶胞的晶胞参数均为apm,晶体密度为
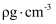 ,设NA为阿伏加德罗常数的值,则普鲁士白(化学式为最简比值)的摩尔质量为
,设NA为阿伏加德罗常数的值,则普鲁士白(化学式为最简比值)的摩尔质量为 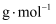 (用含a、
(用含a、 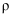 、NA的计算式表示)
、NA的计算式表示)
氰化物剧毒,工业上采用  将废水中的
将废水中的 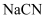 氧化成无毒物质,反应为
氧化成无毒物质,反应为  。下列有关说法正确的是( )
。下列有关说法正确的是( )
 将废水中的
将废水中的 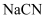 氧化成无毒物质,反应为
氧化成无毒物质,反应为  。下列有关说法正确的是( )
。下列有关说法正确的是( )
A . 该反应涉及两种共价化合物
B . 中子数为19的氯原子为  C .
C .  的电子式为
的电子式为  D .
D .  中含离子键和共价键
中含离子键和共价键
 C .
C .  的电子式为
的电子式为  中含离子键和共价键
中含离子键和共价键
分析下列化学式中划有横线的元素,选出符合要求的物质填空(填序号)。
A. NH3B. H2OC.HClD. CH4E. C2H6F.N2
-
(1) 所有的价电子都参与形成共价键的是 。
-
(2) 只有一个价电子参与形成共价键的是。
-
(3) 最外层有未参与成键的电子对的是 。
-
(4) 既有σ键又有π键的是。
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。回答下列问题:
-
(1) 钒(V)及其化合物广泛应用于工业催化、新材料等领域。
①基态钒原子的价电子排布式为。
②
 是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:
是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示: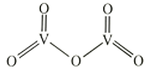
则
 分子中σ键和π键数目之比为。
分子中σ键和π键数目之比为。 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。
溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。 与
与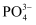 的空间构型相同,其中V原子的杂化方式为。
的空间构型相同,其中V原子的杂化方式为。 -
(2) ①科学研究表明用
 作光催化剂可处理废水中的
作光催化剂可处理废水中的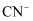 , 则
, 则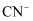 的电子式为。
的电子式为。②
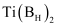 是一种储氢材料。基态B原子核外电子的运动状态有种。
是一种储氢材料。基态B原子核外电子的运动状态有种。 -
(3) 甘氨酸亚铁络合物[
 ]广泛用于缺铁性贫血的预防和治疗。
]广泛用于缺铁性贫血的预防和治疗。①
 中含有的第二周期元素的第一电离能由大到小的顺序为(用元素符号表示)。
中含有的第二周期元素的第一电离能由大到小的顺序为(用元素符号表示)。②甘氨酸 (
 )的沸点比相对分子质量相近的烷烃大很多,原因是。
)的沸点比相对分子质量相近的烷烃大很多,原因是。
在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出了如图 的转化过程。下列说法正确的是( )
的转化过程。下列说法正确的是( )
 的转化过程。下列说法正确的是( )
的转化过程。下列说法正确的是( )
A . 铜元素位于周期表中的d区
B . 步骤④中仅有共价键的断裂
C . 甲酸乙酯是该过程的中间产物
D . 该反应过程中,催化剂不参与反应,只是降低了反应的活化能
离子液体具有良好的化学稳定性、较低的熔点以及对多种物质有良好的溶解性,因此应用广泛,1-乙基-3-甲基咪唑四氟硼酸盐的结构如图:
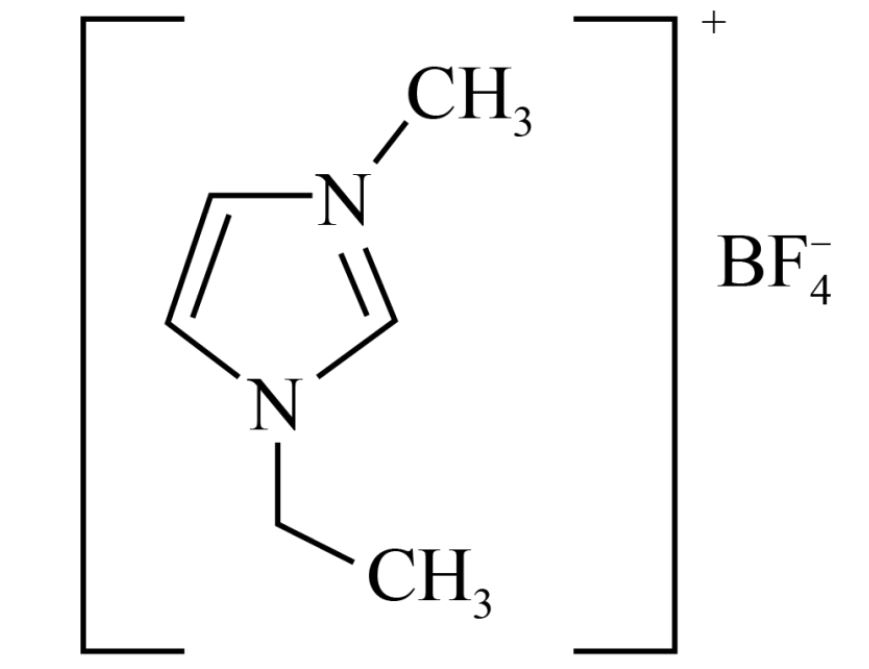
下列说法错误的是( )
A . 五元环上的C、N均是sp2杂化
B . 阳离子的化学式为 C . 该离子液体中存在的化学键类型:离子键、共价键、配位键
D . 阴离子的空间构型为正四面体
C . 该离子液体中存在的化学键类型:离子键、共价键、配位键
D . 阴离子的空间构型为正四面体
 C . 该离子液体中存在的化学键类型:离子键、共价键、配位键
D . 阴离子的空间构型为正四面体
C . 该离子液体中存在的化学键类型:离子键、共价键、配位键
D . 阴离子的空间构型为正四面体
B、N、O、Fe、Co、Zn等元素及其化合物是生活和工业的重要材料。
-
(1) 上述6种元素在元素周期表中位于ds区的元素有。(填元素符号)
-
(2) 原子中运动电子有两种相反的自旋状态,若一种自旋状态用+
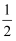 表示,与之相反的用-
表示,与之相反的用-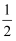 表示,称为电子的自旋磁量子数。对于基态锌原子,其价电子自旋磁量子数的代数和为。
表示,称为电子的自旋磁量子数。对于基态锌原子,其价电子自旋磁量子数的代数和为。
-
(3) 自然界中不存在单质硼,主要存在的是硼的氧化物,从键能角度分析其原因是。
-
(4) 肼(N2H4)可视为NH3分子中的一个氢原子被—NH2取代形成的。肼可用作火箭燃料,其燃烧反应是:N2O4+2N2H4=3N2+4H2O,若该反应中生成3molπ键,则断裂的N—H键有 mol。
-
(5) 量子化学计算预测未知化合物是现代化学的发展途径之一,有人通过计算预言铁存在四氧化物,分子构型是四面体,但该分子中铁为+6价而不是+8价,该分子中铁的价电子排布式为,该分子中氧的化合价有,该分子的结构示意图为。
-
(6) 钴(Co)可形成分子式为Co(NH3)5BrSO4的两种配合物,其中一种的化学式为[Co(NH3)5BrSO4],往其溶液中加BaCl2溶液时,产生白色沉淀;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为。
最近更新



