е…ұд»·й”®зҡ„еҪўжҲҗеҸҠе…ұд»·й”®зҡ„дё»иҰҒзұ»еһӢ зҹҘиҜҶзӮ№йўҳеә“
 вҖӢNF3+3NH4F
вҖӢNF3+3NH4F
-
пјҲ1пјү дёҠиҝ°еҢ–еӯҰж–№зЁӢејҸдёӯзҡ„5з§Қзү©иҙЁжүҖеҗ«зҡ„еҢ–еӯҰй”®зұ»еһӢжңүгҖҖ гҖҖпјҲеЎ«еәҸеҸ·пјүпјҺ
aпјҺзҰ»еӯҗй”®bпјҺе…ұд»·й”®cпјҺй…ҚдҪҚй”®dпјҺйҮ‘еұһй”®
-
пјҲ2пјү дёҺй“ңеұһдәҺеҗҢдёҖе‘ЁжңҹпјҢдё”жңӘжҲҗеҜ№д»·з”өеӯҗж•°жңҖеӨҡзҡ„е…ғзҙ еҹәжҖҒеҺҹеӯҗд»·з”өеӯҗжҺ’еёғејҸдёә
-
пјҲ3пјү NF3зҡ„жІёзӮ№жҜ”NH3зҡ„жІёзӮ№пјҲп№Ј33в„ғпјүдҪҺеҫ—еӨҡзҡ„дё»иҰҒеҺҹеӣ жҳҜ
-
пјҲ4пјү зҗҶи®әдёҠHFгҖҒNaAlO2е’ҢNaClжҢү6пјҡ1пјҡ2зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”жҒ°еҘҪеҸҚеә”з”ҹжҲҗHClгҖҒH2Oе’ҢдёҖз§Қеҫ®жә¶дәҺж°ҙзҡ„йҮҚиҰҒеҺҹж–ҷпјҢиҜҘзү©иҙЁеҗ«жңүдёүз§Қе…ғзҙ пјҢеңЁйҮ‘еұһй“қзҡ„еҶ¶зӮјдёӯжңүйҮҚиҰҒдҪңз”ЁпјҺиҜҘзү©иҙЁдёәй…ҚеҗҲзү©пјҢе…¶дёӯеҝғзҰ»еӯҗжҳҜгҖҖ пјҢй…ҚдҪҚж•°дёә
-
пјҲ5пјү ж №жҚ®дёӢеҲ—дә”з§Қе…ғзҙ зҡ„第дёҖиҮіз¬¬еӣӣз”өзҰ»иғҪж•°жҚ®пјҲеҚ•дҪҚпјҡkJвҖўmolп№Ј1 пјүпјҢеӣһзӯ”дёӢйқўеҗ„йўҳпјҡ
е…ғзҙ д»ЈеҸ·
I1
I2
I3
I4
Q
2080
4000
6100
9400
R
500
4600
6900
9500
S
740
1500
7700
10500
T
580
1800
2700
11600
U
420
3100
4400
5900
в‘ еңЁе‘ЁжңҹиЎЁдёӯпјҢжңҖеҸҜиғҪеӨ„дәҺеҗҢдёҖж—Ҹзҡ„жҳҜгҖҖ гҖҖе’ҢгҖҖ гҖҖпјҺ
в‘ЎTе…ғзҙ жңҖеҸҜиғҪжҳҜгҖҖ пјҲеЎ«вҖңsвҖқгҖҒвҖңpвҖқгҖҒвҖңdвҖқгҖҒвҖңdsвҖқзӯүпјүеҢәе…ғзҙ пјҺиӢҘTдёә第дәҢе‘Ёжңҹе…ғзҙ пјҢFжҳҜ第дёүе‘Ёжңҹе…ғзҙ дёӯеҺҹеӯҗеҚҠеҫ„жңҖе°Ҹзҡ„е…ғзҙ пјҢеҲҷTгҖҒFеҪўжҲҗеҢ–еҗҲзү©зҡ„з©әй—ҙжһ„еһӢдёә пјҢе…¶дёӯеҝғеҺҹеӯҗзҡ„жқӮеҢ–иҪЁйҒ“зұ»еһӢдёә
 B . H2O2зҡ„з”өеӯҗејҸпјҡ
B . H2O2зҡ„з”өеӯҗејҸпјҡ еҸӘеӯҳеңЁе…ұд»·й”®зҡ„жҳҜпјҢеҸӘеӯҳеңЁзҰ»еӯҗй”®зҡ„жҳҜпјҢж—ўеӯҳеңЁзҰ»еӯҗй”®еҸҲеӯҳеңЁе…ұд»·й”®зҡ„жҳҜпјҢдёҚеӯҳеңЁеҢ–еӯҰй”®зҡ„жҳҜпјҲеЎ«еәҸеҸ·пјүгҖӮ
-
пјҲ1пјү Fe3+еҹәжҖҒж ёеӨ–з”өеӯҗжҺ’еёғејҸдёәгҖӮ
-
пјҲ2пјү дёҺO3еҲҶеӯҗдә’дёәзӯүз”өеӯҗдҪ“зҡ„дёҖз§ҚйҳҙзҰ»еӯҗдёәпјҲеЎ«еҢ–еӯҰејҸпјүгҖӮ
-
пјҲ3пјү N2еҲҶеӯҗдёӯПғй”®дёҺПҖй”®зҡ„ж•°зӣ®жҜ”nпјҲПғпјүвҲ¶nпјҲПҖпјү=гҖӮ
-
пјҲ4пјү [Fe(H2O)6]2+дёҺNOеҸҚеә”з”ҹжҲҗзҡ„[Fe(NO)(H2O)5]2+дёӯпјҢNOд»ҘNеҺҹеӯҗдёҺFe2+еҪўжҲҗй…ҚдҪҚй”®гҖӮиҜ·еңЁ[Fe(NO)(H2O)5]2+з»“жһ„зӨәж„Ҹеӣҫзҡ„зӣёеә”дҪҚзҪ®иЎҘеЎ«зјәе°‘зҡ„й…ҚдҪ“

в‘ жҷ¶дҪ“дёӯеҺҹеӯҗе‘Ҳе‘ЁжңҹжҖ§жңүеәҸжҺ’еҲ—пјҢжңүиҮӘиҢғжҖ§пјӣиҖҢйқһжҷ¶дҪ“дёӯеҺҹеӯҗжҺ’еҲ—зӣёеҜ№ж— еәҸпјҢж— иҮӘиҢғжҖ§
в‘Ўеҗ«жңүйҮ‘еұһйҳізҰ»еӯҗзҡ„жҷ¶дҪ“дёҖе®ҡжҳҜзҰ»еӯҗжҷ¶дҪ“
в‘ўе…ұд»·й”®еҸҜеҶіе®ҡеҲҶеӯҗжҷ¶дҪ“зҡ„зҶ”гҖҒжІёзӮ№
в‘ЈMgOзҡ„жҷ¶ж јиғҪиҝңжҜ”NaClеӨ§пјҢиҝҷжҳҜеӣ дёәеүҚиҖ…зҰ»еӯҗжүҖеёҰзҡ„з”өиҚ·ж•°еӨҡпјҢзҰ»еӯҗеҚҠеҫ„е°Ҹ
в‘Өжҷ¶иғһжҳҜжҷ¶дҪ“з»“жһ„зҡ„еҹәжң¬еҚ•е…ғ
в‘Ҙжҷ¶дҪ“е°ҪеҸҜиғҪйҮҮеҸ–зҙ§еҜҶе Ҷз§Ҝж–№ејҸпјҢд»ҘдҪҝе…¶еҸҳеҫ—жҜ”иҫғзЁіе®ҡ
в‘ҰCsClе’ҢNaClжҷ¶дҪ“дёӯйҳҙгҖҒйҳізҰ»еӯҗзҡ„й…ҚдҪҚж•°йғҪдёә6

дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
 жҳҜдёҖз§Қжё…жҙҒгҖҒе®үе…Ёзҡ„ж ёиҒҡеҸҳеҸ‘з”өзҮғж–ҷгҖӮдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
жҳҜдёҖз§Қжё…жҙҒгҖҒе®үе…Ёзҡ„ж ёиҒҡеҸҳеҸ‘з”өзҮғж–ҷгҖӮдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
 д№Ӣй—ҙйҖҡиҝҮе…ұд»·й”®еҪўжҲҗеҚ•иҙЁеҲҶеӯҗ
C .
д№Ӣй—ҙйҖҡиҝҮе…ұд»·й”®еҪўжҲҗеҚ•иҙЁеҲҶеӯҗ
C .  еҸ‘з”өд»ЈжӣҝзҒ«з”өжңүеҲ©дәҺе®һзҺ°зўіиҫҫеі°
D . зӯүзү©иҙЁзҡ„йҮҸзҡ„
еҸ‘з”өд»ЈжӣҝзҒ«з”өжңүеҲ©дәҺе®һзҺ°зўіиҫҫеі°
D . зӯүзү©иҙЁзҡ„йҮҸзҡ„ дёҺ
дёҺ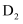 жүҖеҗ«дёӯеӯҗж•°зӣёзӯү
жүҖеҗ«дёӯеӯҗж•°зӣёзӯү
 жҳҜеҲ¶еӨҮй“Ғи§ҰеӘ’дёҠзҡ„дё»иҰҒеҺҹж–ҷгҖӮеңЁе…үз…§дёӢеҲҶи§Јпјҡ
жҳҜеҲ¶еӨҮй“Ғи§ҰеӘ’дёҠзҡ„дё»иҰҒеҺҹж–ҷгҖӮеңЁе…үз…§дёӢеҲҶи§Јпјҡ  гҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
гҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү еҹәжҖҒ
 еҺҹеӯҗзҡ„з”өеӯҗжҺ’еёғејҸдёәпјҢеҹәжҖҒ
еҺҹеӯҗзҡ„з”өеӯҗжҺ’еёғејҸдёәпјҢеҹәжҖҒ  дёҺ
дёҺ  дёӯжңӘжҲҗеҜ№з”өеӯҗзҡ„ж•°зӣ®д№ӢжҜ”дёәгҖӮ
дёӯжңӘжҲҗеҜ№з”өеӯҗзҡ„ж•°зӣ®д№ӢжҜ”дёәгҖӮ
-
пјҲ2пјү дёүиҚүй…ёеҗҲй“Ғй…ёй’ҫжүҖеҗ«е…ғзҙ дёӯпјҢ第дёҖз”өзҰ»иғҪжңҖеӨ§зҡ„жҳҜ(еЎ«е…ғзҙ з¬ҰеҸ·пјҢдёӢеҗҢ)пјҢз”өиҙҹжҖ§жңҖеӨ§зҡ„жҳҜгҖӮ
-
пјҲ3пјү 1дёӘ
 дёҺ1дёӘ
дёҺ1дёӘ  еҲҶеӯҗдёӯ
еҲҶеӯҗдёӯ 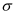 й”®ж•°зӣ®д№ӢжҜ”дёәпјҢ
й”®ж•°зӣ®д№ӢжҜ”дёәпјҢ  еҲҶеӯҗзҡ„з«ӢдҪ“жһ„еһӢдёәгҖӮ
еҲҶеӯҗзҡ„з«ӢдҪ“жһ„еһӢдёәгҖӮ
-
пјҲ4пјү йҮ‘еҲҡзҹізҡ„жҷ¶иғһз»“жһ„еҰӮеӣҫжүҖзӨәпјҢзўіеҺҹеӯҗеҲҶеҲ«дҪҚдәҺйЎ¶зӮ№гҖҒйқўеҝғе’ҢдҪ“еҶ…гҖӮ
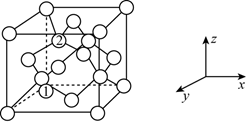
иӢҘеӣҫдёӯеҺҹеӯҗ1зҡ„еқҗж Үдёә
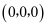 пјҢеҲҷеҺҹеӯҗ2зҡ„еқҗж ҮдёәгҖӮ
пјҢеҲҷеҺҹеӯҗ2зҡ„еқҗж ҮдёәгҖӮ



