共价键的形成及共价键的主要类型 知识点题库
下列有关σ键的说法中,错误的是( )
A . 如果电子云图像是由两个s电子重叠形成的,即形成了s-ssσ键
B . s电子与p电子可以形成s-pσ键
C . p电子与p电子不能形成σ键
D . HCl分子里含有一个s-pσ键
某晶体中含有极性键,关于该晶体的说法错误的是( )
A . 不可能有很高的熔沸点
B . 不可能是单质
C . 可能是有机物
D . 可能是离子晶体
下列说法中不正确的是( )
A . 非金属元素形成的化合物不可能是离子化合物
B . 金属原子和非金属原子间也可形成共价键
C . 离子化合物中可能含有共价键
D . 共价化合物中不可能含有离子键
下列物质中,属于共价化合物的是( )
A . NH4Cl
B . SO2
C . Cl2
D . Na2SO4
下列说法正确的是( )
A . 在离子化合物中,可能含共价键
B . 在共价化合物中,可能含离子键
C . 含共价键的化合物一定是共价化合物
D . 含离子键的化合物不一定是离子化合物
某固体化合物的化学式NH5 , 它的所有原子的最外层都符合稀有气体原子的电子层结构,则下列说法中,正确的是( )
A . 它与足量的水反应的化学方程式为:NH5+H2O═NH3•H2O+H2↑
B . NH5中只有极性共价键的共价化合物
C . 1molNH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数)
D . NH5中所有原子最外层均为8个电子
下列物质中含有共价键的离子化合物是( )
A . CaF2
B . KOH
C . CO2
D . CH4
下列说法中不正确的是( )
A . σ键是原子轨道以“头碰头”的方式相互重叠
B . 共价化合物分子的键能越大,键长越长,则分子越稳定
C . 2个原子形成多个共价键中,只有一个σ键,而π键可以是一个或多个
D . 形成共价键时键与键重叠程度越大,体系能量越底,键越稳定
HgCl2的稀溶液可用作手术刀的消毒剂,已知熔融的HgCl2不导电,而HgCl2的稀溶液有弱的导电能力,下列关于HgCl2的叙述正确的是( )
A . HgCl2属于离子化合物
B . HgCl2属于共价化合物
C . HgCl2属于非电解质
D . HgCl2是弱酸弱碱盐
下列过程中,共价键被破坏的是( )
A . 碘开华
B . 二氧化氮被木炭吸附
C . 蔗糖溶于水
D . HCl气体溶于水
下列物质既含离子键又含共价键的是( )
A . CaCl2
B . NH4Cl
C . MgF2
D . H2O2
下列物质的变化过程中,有共价键明显被破坏的是( )
A . I2升华
B . NaCl颗粒被粉碎
C . H2SO4溶于水得硫酸溶液
D . NaOH受热熔化
下列说法正确的是( )
A . 干冰和石英晶体中的化学键类型相同,熔化时需客服微粒间的作用力类型也相同
B . 化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键
C . CH4和CCl4中,每个原子的最外层都具有8电子稳定结构
D . NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响
X、Y、Z、W、R为元素周期表前二十号元素,原子序数依次增大,其中有两种元素同主族。X原子的核外电子数是电子层数的三倍,X、Y 化合形成温室气体 M,X、Z原子最外层电子数之和等于Y的族序数,W 的单质常温下为黄绿色气体。回答下列问题:
-
(1) 写出元素符号:X,Y,R。
-
(2) W 的原子结构示意图为。
-
(3) M 的电子式为,属于(填“共价”或“离子”)化合物。
-
(4) Z、W、R简单离子半径由大到小的顺序为(填离子符号)。
-
(5) Z、R的最高价氧化物对应水化物碱性由强到弱的顺序为(填化学式)。
-
(6) 用电子式表示Y 的最简单氢化物的形成过程:。
下列说法正确的是( )
①氢键是一种化学键 ②由非金属元素组成的化合物可能是离子化合物 ③离子键只是阳离子、阴离子的相互吸引 ④气体单质分子中一定含有共价键 ⑤由不同种元素组成的多原子分子中,一定只存在极性共价键 ⑥离子化合物中可能有共价键 ⑦共价化合物中可能有离子键
A . ②⑥
B . ①②③
C . ②④⑤
D . ②④⑤⑥
下列物质中,既含共价键又含离子键的是( )
A . KCl
B . CO2
C . MgCl2
D . NaOH
下列物质中,既有离子键又有共价键的是( )
A . KCl
B . C6H12O6
C . H2O
D . NaOH
σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道或一个原子的p轨道和另一个原子的p轨道以“头碰头"方式重叠构建而成。则下列分子中的σ键是由两个原子的s轨道以“头碰头"方式重叠构建而成的是( )
A . H2
B . HCl
C . Cl2
D . F2
-
(1) CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,基态Cr原子的价层电子排布式为CrO2Cl2是 分子(填“极性"或“非极性")。
-
(2) HC=CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为;乙炔钠中存在(填序号)。
A.金属键
B.σ键
C.π键
D.氢键
E.配位键
F.离子键
G.范德华力
-
(3) 分子式为[Pt( NH3)2Cl4]的配合物有两种不同的颜色,其中呈橙黄色的物质较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如图甲所示的结构示意图中呈亮黄色的是(填“A"或“B")。
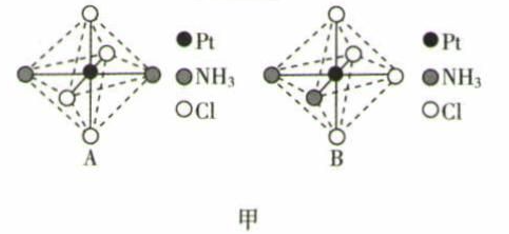
-
(4) 芦笋中的天冬酰胺具有提高身体免疫力的功效,结构如图乙所示。其组成元素第一电离能由大到小的顺序为(用元素符号表示)。
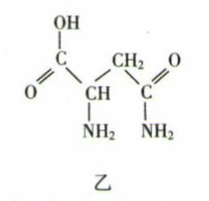
-
(5) 某离子晶体的晶胞结构如图丙所示:

①晶体中在每个X周围与它最近且距离相等的X共有个。
②设该晶体的摩尔质量为Mg·mol-1 , 晶体的密度为 ρg·cm-3 ,阿伏加德罗常数的值为NA , 则晶体中两个最近的X间的距离为pm。
下列物质中既含有共价键又含有离子键的是( )
A . Na2O
B . CaCl2
C . KOH
D . HCl
最近更新



