共价键的形成及共价键的主要类型 知识点题库
下列化合物中既含有离子键又含有共价键的是 ( )
A . HNO3
B . CaCl2
C . NH4Cl
D . H2SO4
现有①BaCl2 ②金刚石 ③KOH ④H2SO4 ⑤干冰 ⑥碘片 ⑦晶体硅 ⑧金属铜 八种物质,按下列要求回答:(填序号)
(1)熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是 , 熔点最高的是 ,熔点最低的是 .
(2)属于离子化合物的是 ,只有离子键的物质是 ,晶体以分子间作用力结合的是 .
(3)请写出③的电子式 ,⑤的电子式
已知:(1)Al(OH)3的电离方程式为:AlO2﹣+H++H2O⇌Al(OH)3⇌Al3++3OH﹣(2)电解熔融AlCl3不能得到金属铝,AlCl3溶于水的电离方程式为:AlCl3=Al3++3Cl﹣(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb,则下列关于Al(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是( )
A . 均为强电解质
B . 均为弱电解质
C . 均为离子化合物
D . 均为共价化合物
下列过程中,共价键被破坏的是( )
A . 碘升华
B . 溴蒸气被木炭吸附
C . 酒精溶于水
D . HCl气体溶于水
下列7种固态物质:A.P4、B.SiO2、C.NH4Cl、D.Ca(OH)2、E.NaF、F.CO2(干冰)、G.金刚石,将正确的序号(字母)填入下列空中.
-
(1) 既有离子键又有共价键的是.
-
(2) 熔化时不需要破坏化学键的是,熔化时需要破坏共价键的是.
下列说法中不正确的是( )
①质子数相同的微粒一定属于同一种元素
②共价化合物中不存在离子键
③质子数相同,电子数也相同的两种微粒,不可能是一种分子和一种离子
④电子数相同的微粒不一定是同一种元素
⑤非金属元素之间不可能形成离子键
⑥离子键是指阴阳离子间的静电吸引力
⑦水受热不容易分解,原因是水分子间存在氢键
A . ②③⑤⑥
B . ①③⑤⑦
C . ①⑤⑥⑦
D . ③④⑤⑥
黄铜矿(主要成分为CuFeS2)是生产铜、铁和硫酸的原料。回答下列问题:
-
(1) 基态Cu原子的价电子排布式为
-
(2) 从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)I1(Cu)(填“>“<"或“=”)
-
(3) 血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+ )可用于治疗缺铁性贫血。吡略和血红素的结构如下图:
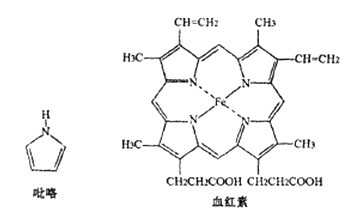
①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为
②1mol吡咯分子中所含的σ键总数为个。分子中的大π键可用中表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为。
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为(填化学式)。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过键相结合。
-
(4) 黄铜矿冶炼铜时产生的SO2可经过SO2
 SO3
SO3  H2SO4途径形成酸雨。SO2的空间构型为。H2SO4的酸性强于H2SO3的原因是
H2SO4途径形成酸雨。SO2的空间构型为。H2SO4的酸性强于H2SO3的原因是
-
(5) 用石墨作电极处理黄铜矿可制得硫酸铜溶液和单质硫。石墨的晶体结构如下图所示,虚线勾勒出的是其晶胞。则石墨晶胞中含碳原子数为个。已知石墨的密度为ρg/cm3 , C-C键的键长为rcm,设阿伏加德罗常数的值为NA , 则石墨晶体的层间距d=cm。

下列化合物分子中只含σ键不含π键的是 ( )
A . CO2
B . COCl2
C . C2H2
D . H2O2
下列物质中,既含有离子键又含有共价键的是( )
A . NaCl
B . C2H4
C . NaOH
D . CaCl2
含有两种不同类型化学键的物质是( )
A . NaOH
B . N2
C . CaCl2
D . CO2
已知  呈粉红色,
呈粉红色,  呈蓝色,
呈蓝色,  为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:  ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
 呈粉红色,
呈粉红色,  呈蓝色,
呈蓝色,  为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:  ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下: 
以下结论和解释正确的是( )
A . 等物质的量的  和
和  中σ键数之比为3:2
B . 由实验①可推知△H<0
C . 实验②是由于c(H2O)增大,导致平衡逆向移动
D . 由实验③可知配离子的稳定性:
中σ键数之比为3:2
B . 由实验①可推知△H<0
C . 实验②是由于c(H2O)增大,导致平衡逆向移动
D . 由实验③可知配离子的稳定性: 
 和
和  中σ键数之比为3:2
B . 由实验①可推知△H<0
C . 实验②是由于c(H2O)增大,导致平衡逆向移动
D . 由实验③可知配离子的稳定性:
中σ键数之比为3:2
B . 由实验①可推知△H<0
C . 实验②是由于c(H2O)增大,导致平衡逆向移动
D . 由实验③可知配离子的稳定性: 
下列说法正确的是:( )
A . π键是由两个p电子“头碰头”重叠形成的
B . σ键是镜面对称,而π键是轴对称
C . 乙烷分子中的键全为σ键,乙烯分子中含σ键和π键
D . H2分子中含σ键,Cl2分子中含π键
下列化合物中既含离子键又含共价键的是( )
A . CO2
B . H2O
C . NaOH
D . BaCl2
下列各组物质中,都含有共价键,却又都不属于共价化合物的一组是( )
A . 
 B .
B . 
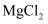 C .
C . 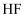
 D .
D . 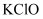


 B .
B . 
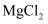 C .
C . 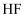
 D .
D . 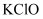

已知:X、Y、Z、W四种元素原子的电负性如表所示:
元素 | X | Y | Z | W |
电负性 | 2.5 | 4.0 | 1.2 | 2.4 |
上述四种元素中,最容易形成共价键的是( )
A . X与Y
B . X与W
C . Y与Z
D . Y与W
下列物质中只含有极性共价键的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
Negishi偶联反应是构筑碳碳键的重要方法之一,反应过程如图所示(R、R'表示烃基)。下列说法正确的是( )
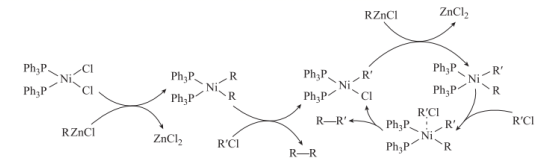
A . RZnCl是该反应的催化剂
B . 反应过程中只生成一种偶联有机产物
C . 反应过程中涉及极性键的断裂和非极性键的形成
D . 存在反应  +RZnCl=
+RZnCl=  +ZnCl2
+ZnCl2
 +RZnCl=
+RZnCl=  +ZnCl2
+ZnCl2
下列物质中,含有共价键的是( )
A . Cl2
B . KCl
C . NaBr
D . MgO
下列关于 键和
键和 键的说法错误的是( )
键的说法错误的是( )
 键和
键和 键的说法错误的是( )
键的说法错误的是( )
A .  键都有方向性,
键都有方向性, 键都有饱和性
B . 两个成键原子之间最多有一个
键都有饱和性
B . 两个成键原子之间最多有一个 键
C .
键
C .  分子中存在
分子中存在 键,电子云图像呈轴对称
D .
键,电子云图像呈轴对称
D . 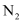 分子中有两个
分子中有两个 键,且相互垂直
键,且相互垂直
 键都有方向性,
键都有方向性, 键都有饱和性
B . 两个成键原子之间最多有一个
键都有饱和性
B . 两个成键原子之间最多有一个 键
C .
键
C .  分子中存在
分子中存在 键,电子云图像呈轴对称
D .
键,电子云图像呈轴对称
D . 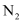 分子中有两个
分子中有两个 键,且相互垂直
键,且相互垂直
反应Cl2+Na2SO3+H2O=Na2SO4+2HCl可用于污水脱氯。下列说法正确的是( )
A . 中子数为20的氯原子: Cl
B . H2O分子中含极性共价键
C . Na+的结构示意图:
Cl
B . H2O分子中含极性共价键
C . Na+的结构示意图: D . HCl的电子式:
D . HCl的电子式:
 Cl
B . H2O分子中含极性共价键
C . Na+的结构示意图:
Cl
B . H2O分子中含极性共价键
C . Na+的结构示意图: D . HCl的电子式:
D . HCl的电子式:最近更新



