共价键的形成及共价键的主要类型 知识点题库
在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
A . 将SO2通入水中
B . 火碱溶于水
C . 将HCl通入水中
D . 硫酸氢钠溶于水
下列物质中,只含共价键的化合物是( )
A . N2
B . CO2
C . MgO
D . NaOH
下列叙述正确的是( )
A . 离子键只存在于金属阳离子与酸根阴离子之间
B . 两种非金属元素形成AB型化合物,它一定含共价键
C . 物质中化学键破坏了,一定发生化学变化
D . 化学键类型一定由元素类别决定
下列物质中属于共价化合物的是( )
A . HNO3
B . NaHSO4
C . Na2O2
D . I2
下列物质中,既含共价键又含离子键的是( )
A . KCl
B . H2O
C . Na2O2
D . CO2
铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如图;已知CN﹣与N2结构相似,1molCN﹣中π键数目为.

下列物质属于共价化合物的是( )
A . NH4Cl
B . MgO
C . H2O
D . CaCl2
关于乙醇分子的说法正确的是( )
A . 分子中共含有8个极性键
B . 分子中不含非极性键
C . 分子中只含σ键
D . 分子中含有1个π键
A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
-
(1) A 元素的单质为A2 , 不能形成A3或A4 , 这体现了共价键的性;B元素单质的一种空间网状结构的晶体熔点>3550℃,该单质的晶体类型属于;基态D原子共有种不同运动状态的电子。
-
(2) A与C形成的最简单分子的中心原子杂化方式是,该分子与D2+、H2O以2:1:2的配比结合形成的配离子是(填化学式),此配离子中的两种配体的不同之处为(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数 ③中心原子的化学键类型 ④VSEPR模型
-
(3) 1molBC—中含有的π键数目为;写出与BC-互为等电子体的分子和离子各一种、。
-
(4) D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原 因是。
-
(5) D3C 具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3—半径分别为apm、bpm,D+和C3—都是紧密接触的刚性小球,则C3—的配位数为,晶体的密度为g·cm-3。

下列属于共价化合物的是( )
A . NH4NO3
B . CH4
C . CaCl2
D . C60
下列物质中属于共价化合物的是( )
A . HCl
B . Na2CO3
C . NaCl
D . N2
H2O分子中每个O原子结合2个H原子的根本原因是( )
A . 共价键的方向性
B . 共价键的键长
C . 共价键的键角
D . 共价键的饱和性
下列过程中,共价键被破坏的是( )
A . 碘升华
B . 溴蒸气被木炭吸附
C . 水结为冰
D . 氯化氢气体溶于水
三氯化氮(NCl3)是一种淡黄色的油状液体,其分子空间构型与NH3相似。则下面对于NCl3的描述正确的是 ( )
A . 是由极性键形成的非极性分子
B . 它的挥发性比PBr3要小
C . 它还能再以配位键与H+结合
D . Cl-N-Cl的键角是120°
下列各组物质中所含化学键均只有共价键的是( )
A . NaCl和K2O2
B . HCl和H2O
C . HNO3与NH4NO3
D . K2SO4与SO3
下列物质的构成微粒中,不含共价键的是( )
A . MgCl2
B . Cl2
C . HCl
D . NaOH
下列说法正确的是( )
A . 反应H2+Cl2  2HCl,破坏了原有共价键又形成了新的共价键
B . NaOH熔化时,既破坏了离子键又破坏了共价键
C . 破坏化学键的过程,一定是化学变化过程
D . 35Cl和37Cl的相互转化属于化学变化
2HCl,破坏了原有共价键又形成了新的共价键
B . NaOH熔化时,既破坏了离子键又破坏了共价键
C . 破坏化学键的过程,一定是化学变化过程
D . 35Cl和37Cl的相互转化属于化学变化
 2HCl,破坏了原有共价键又形成了新的共价键
B . NaOH熔化时,既破坏了离子键又破坏了共价键
C . 破坏化学键的过程,一定是化学变化过程
D . 35Cl和37Cl的相互转化属于化学变化
2HCl,破坏了原有共价键又形成了新的共价键
B . NaOH熔化时,既破坏了离子键又破坏了共价键
C . 破坏化学键的过程,一定是化学变化过程
D . 35Cl和37Cl的相互转化属于化学变化
在乙烯分子中有5个σ键和1个π键,它们分别是( )
A . sp2杂化轨道形成σ键,未杂化的2p轨道形成π键
B . sp2杂化轨道形成π键,未杂化的2p轨道形成σ键
C . C-H之间是sp2杂化轨道形成σ键,C-C之间是未杂化的2p轨道形成π键
D . C-C之间是sp2杂化轨道形成σ键,C-H之间是未杂化的2p轨道形成π键
下列说法正确的有几句( )
①离子键与共价键的本质都是静电作用 ②任何物质中都存在化学键 ③氢键是极弱的化学键 ④离子键就是阴、阳离子之间的静电吸引力 ⑤活泼金属与活泼非金属化合时能形成离子键 ⑥任何共价键中,成键原子成键后均满足稳定结构 ⑦验证化合物是否为离子化合物的实验方法是可以看其熔化状态下能否导电 ⑧两种非金属元素形成的化合物不可能含有离子键 ⑨化学键断裂,一定发生化学变化
A . 1
B . 2
C . 3
D . 4
下列说法错误的是( )
A . 杂化轨道可用于形成 键和
键和 键
B . 若中心原子杂化方式相同,分子中孤电子对数越多,键角越小
C .
键
B . 若中心原子杂化方式相同,分子中孤电子对数越多,键角越小
C .  和
和 的
的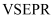 空间构型和分子空间构型均不一致
D . 价电子对互斥理论一般不适用于推测过渡金属化合物分子的空间构型
空间构型和分子空间构型均不一致
D . 价电子对互斥理论一般不适用于推测过渡金属化合物分子的空间构型
 键和
键和 键
B . 若中心原子杂化方式相同,分子中孤电子对数越多,键角越小
C .
键
B . 若中心原子杂化方式相同,分子中孤电子对数越多,键角越小
C .  和
和 的
的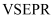 空间构型和分子空间构型均不一致
D . 价电子对互斥理论一般不适用于推测过渡金属化合物分子的空间构型
空间构型和分子空间构型均不一致
D . 价电子对互斥理论一般不适用于推测过渡金属化合物分子的空间构型
最近更新



