共价键的形成及共价键的主要类型 知识点
共价键的形成:元素原子通过共用电子对形成的化学键即是共价键。
共价键的主要类型:根据共用电子对是否偏移,共价键分为极性共价键和非极性共价键,当电子对出现偏移时是极性共价键,不偏移时是非极性共价键。
共价键的主要类型:根据共用电子对是否偏移,共价键分为极性共价键和非极性共价键,当电子对出现偏移时是极性共价键,不偏移时是非极性共价键。
共价键的形成及共价键的主要类型 知识点题库
物质发生变化时,其中的化学键可能被破坏,也有可能不变。下列变化中共价键被破坏的是( )
A . NaOH溶于水
B . 冰熔化为水
C . 碘晶体升华
D . HCl溶于水
氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103 Pa),但在180℃就开始升华,据此判断,氯化铝是(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是.
碳元素的单质有多种形式,如图依次是C60、石墨和金刚石的结构图:
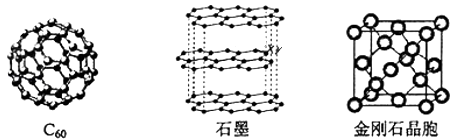
回答下列问题:
-
(1) 金刚石、石墨、C60、碳纳米管都是碳元素的单质形式,它们互为.
-
(2) 金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为、.
-
(3) C60属于晶体,石墨属于晶体.
-
(4) 石墨晶体中,层内C﹣C键的键长为142pm,而金刚石中C﹣C键的键长为154pm.其原因是金刚石中只存在C﹣C间的共价键,而石墨层内的C﹣C间不仅存在共价键,还有键.
-
(5) 金刚石晶胞含有个碳原子.若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=a,列式表示碳原子在晶胞中的空间占有率(不要求计算结果).
甲醛分子(CH2O)的中心原子(碳原子)的价层电子对数为,其孤电子对数为,则该分子呈形.甲醛分子的中心原子的杂化类型为,分子中共有个σ键,有个π键,其中C﹣H的σ键的类型为,C﹣O的σ键的类型为.
a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( )
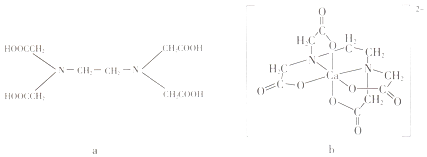
A . b含有分子内氢键
B . b中Ca2+的配位数为4
C . b含有共价键、离子键和配位键
D . a和b中的N原子均为sp3杂化
下列含有非极性键的共价化合物是( )
A . N2
B . Na2O2
C . N2H4
D . CH4
下列叙述正确的是( )
A . 金属与盐溶液的反应都是置换反应
B . 阴离子都只有还原性
C . 离子化合物中肯定存在离子键,可能不存在共价键
D . 与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
下列化合物中既有离子键又有共价键的是( )
A . KBr
B . N2
C . HBr
D . NaOH
下列物质中含有共价键的离子化合物的是( )
A . HCl
B . N2
C . CaCl2
D . NaOH
微粒间的作用力主要有离子键、共价键、金属键(存在于金属单质与合金中)、一般的 分子间作用力和氢键,下列各组物质中,所含有的相互作用力类型最多的一组是( )
A . Na2O2 Na2O
B . KClO CO2
C . K HBr
D . HF NaOH
下列各组物质含有的化学键类型完全相同的是:( )
A . NaOH、CaCl2、CaO
B . Na2O、Na2O2、Na2S
C . NaCl、HCl、H2O
D . HBr、CO2、NH3
最近日本科学家确认世界还存在着另一种“分子足球”  ,它与
,它与  分子结构相似,
分子结构相似,  在高温和撞击后会释放出巨大能量,下列对
在高温和撞击后会释放出巨大能量,下列对  的说法错误的是( )
的说法错误的是( )
 ,它与
,它与  分子结构相似,
分子结构相似,  在高温和撞击后会释放出巨大能量,下列对
在高温和撞击后会释放出巨大能量,下列对  的说法错误的是( )
的说法错误的是( )
A .  高温和撞击后应该生成
高温和撞击后应该生成  B .
B .  和
和  都是氮的同素异形体
C .
都是氮的同素异形体
C .  中氮原子之间由共价键结合
D .
中氮原子之间由共价键结合
D .  和
和  都是氮的同位素
都是氮的同位素
 高温和撞击后应该生成
高温和撞击后应该生成  B .
B .  和
和  都是氮的同素异形体
C .
都是氮的同素异形体
C .  中氮原子之间由共价键结合
D .
中氮原子之间由共价键结合
D .  和
和  都是氮的同位素
都是氮的同位素
下列过程中,共价键被破坏的是( )
A . 乙醇溶于水
B . 氯气溶于水
C . 活性炭吸附二氧化硫
D . 干冰升华
HgCl2稀溶液可用作外科手术刀消毒剂,HgCl2晶体熔点较低,熔融状态下不导电。
-
(1) HgCl2属于化合物(填“离子”或“共价”)。
-
(2) HgCl2和不同浓度NH3-NH4Cl反应得到某种含汞化合物的晶胞结构M如图所示:(部分微粒不在晶胞内)

①写出该含汞化合物的化学式。
②M中
 (填“大于”、“小于”、或“等于”)NH3中的
(填“大于”、“小于”、或“等于”)NH3中的  ,分析原因。
,分析原因。③该含汞化合物晶体在水中的溶解性(填“可溶”或“难溶”),分析原因。
④在晶胞中Cl原子a的分数坐标为(
 ,
,  ,1),则Hg原子b的分数坐标为;晶胞的体积为V cm3 , 则该晶体的密度为
,1),则Hg原子b的分数坐标为;晶胞的体积为V cm3 , 则该晶体的密度为 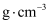 。
。
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
-
(1) 第四周期与基态Ge原子具有相同未成对电子数的元素有(填元素符号);1mol晶体硅与1mol碳化硅所含共价键数目之比为,晶体硅的熔点比碳化硅的熔点 (填“高”或“低”)。
-
(2) SnCl2极易水解生成Sn(OH)Cl沉淀,Sn(OH)Cl中四种元素电负性由小到大的顺序为。在碱溶液中Sn(II)的存在形式为[Sn(OH)3]-(亚锡酸根离子),[Sn(OH)3]-中Sn的价层电子对数为,该离子中存在的化学键类型有 (填标号)。
a.离子键 b.共价键 c.配位键 d.氢键
-
(3) 常温下在水中的溶解度:Na2CO3NaHCO3(填“>”或“<”),用氢键的相关知识解释其原因:。
-
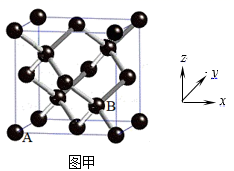
(4) 灰锡的晶体结构与金刚石相似(如图甲所示),其中A处原子的原子分数坐标为(0,0,0),则B处原子的原子分数坐标为。在图乙网格中补全灰锡的晶胞沿y轴的投影图。已知灰锡的密度为ρg·cm-3 , 设NA为阿伏加德罗常数的值,根据硬球接触模型,则Sn原子半径r(Sn)=pm(用代数式表示)。
磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
-
(1) 基态磷原子的核外电子排布式为 。
-
(2) P4S3可用于制造火柴,其分子结构如图甲所示。
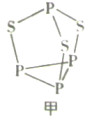
①第一电离能:磷硫(填“>”或“<",下同) ;电负性:磷硫。
②P4S3分子中硫原子的杂化轨道类型为。
③每个P4S3分子中孤电子对的数目为。
-
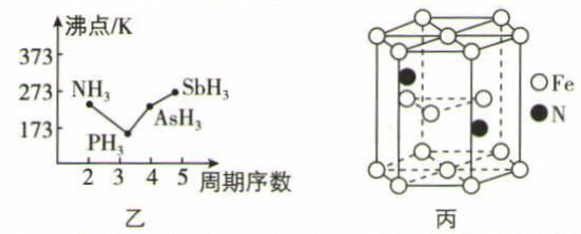
(3) N、P、As、Sb均是第VA族的元素。
①上述元素的简单氢化物的沸点关系如图乙所示,沸点:PH3<NH,原因是;沸点:PH3<AsH3< SbH3 , 原因是 。
②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为。
-
(4) 磷化铝的熔点为2000℃,它与晶体硅的结构类似,磷化铝的晶胞结构如图丁所示。
①磷化铝晶体中磷与铝微粒间的作用力为。
②图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为。
③磷化铝晶体的密度为ρg·cm-3 , 用N\表示阿伏加德罗常数的值,则该晶胞中距离最近的两个铝原子之间的距离为 cm。

中国科学院科研团队研究发现,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如下。下列说法错误的是( )
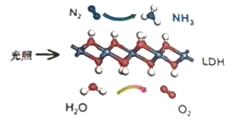
A . 该过程将太阳能转化成为化学能
B . 该过程中,只涉及到极性键的断裂与生成
C . 氧化剂与还原剂的物质的量之比为1:3
D . 原料气N2可通过分离液态空气获得
下图是CO和O在钌催化剂的表面形成化学键的过程。 下列说法正确的是( )
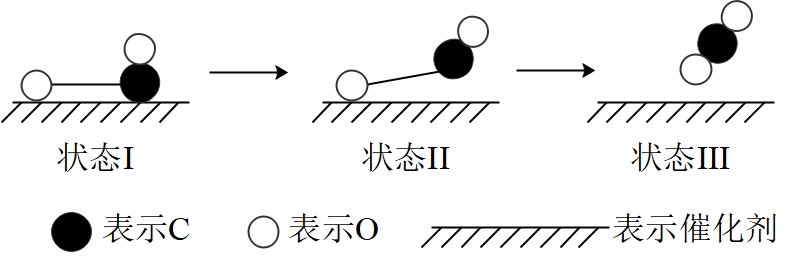
A . CO2和CO都能与碱反应生成盐和水
B . 该过程中,CO先断键成C和O
C . CO与O形成化学键的过程中放出能量
D . 钌催化剂降低了该反应的焓变
氯乙烯是合成高分子材料的单体,我国科研工作者研究出乙炔选择性加成制备氯乙烯的反应历程如图所示。下列说法正确的是( )
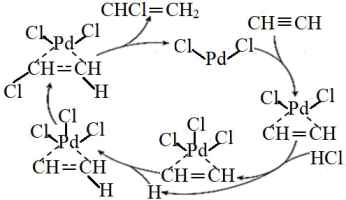
A . 反应过程中 Pd 的成键数目保持不变
B . 反应过程中存在极性键的断裂和形成
C . 发生的反应为: CH≡CH+HCl CH2=CHCl
D . 若反应物改为CH3C≡CCH3 , 则所得产物为 CH3CCl=CClCH3
CH2=CHCl
D . 若反应物改为CH3C≡CCH3 , 则所得产物为 CH3CCl=CClCH3
 CH2=CHCl
D . 若反应物改为CH3C≡CCH3 , 则所得产物为 CH3CCl=CClCH3
CH2=CHCl
D . 若反应物改为CH3C≡CCH3 , 则所得产物为 CH3CCl=CClCH3
下列关于丙炔(CH3C≡CH)的说法错误的是( )
A . 丙炔分子中有6个σ键、2个π键
B . 丙炔分子中碳原子采取 杂化和
杂化和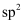 杂化
C . 丙炔分子中存在非极性键和极性键
D . 丙炔分子中有5个原子一定在同一平面上
杂化
C . 丙炔分子中存在非极性键和极性键
D . 丙炔分子中有5个原子一定在同一平面上
 杂化和
杂化和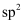 杂化
C . 丙炔分子中存在非极性键和极性键
D . 丙炔分子中有5个原子一定在同一平面上
杂化
C . 丙炔分子中存在非极性键和极性键
D . 丙炔分子中有5个原子一定在同一平面上
最近更新



