反应热的大小比较 知识点
反应热的大小比较 知识点题库
已知700K时,N2+3H2  2NH3 ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2 , 达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2 , 达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是( )
2NH3 ΔH=-Q kJ/mol,现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2 , 达平衡时放出热量 Q1kJ;向密闭容器乙中通入0.5molN2和1.5molH2 , 达平衡时放出热量 Q2kJ。则Q、Q1、Q2的大小关系是( )
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理如下,下列说法正确的是 ( )
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);ΔH=+49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);ΔH=-192.9 kJ·mol-1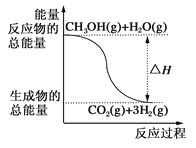
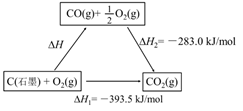
C(s)+O2(g)═CO2(g)△H1
CO2(g)+C(s)═2CO(g)△H2
2CO(g)+O2(g)═2CO2(g)△H3
4Fe(s)+3O2(g)═2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
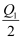 B . Q2<
B . Q2< 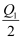 =197 kJ
C . Q2<Q1<197 kJ
D . Q1=Q2=197 kJ
=197 kJ
C . Q2<Q1<197 kJ
D . Q1=Q2=197 kJ
 O2(g)═CO(g)△H2
B . S(s)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(s)△H2
C . 2H2(s)+O2(g)═2H2O(g)△H1 H2(s)+
O2(g)═CO(g)△H2
B . S(s)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(s)△H2
C . 2H2(s)+O2(g)═2H2O(g)△H1 H2(s)+  O2(g)═H2O(g)△H2
D . CaO(s)+H2O(l)═Ca(OH)2(s)△H1; CaCO3(s)═CaO(s)+CO2(g)△H2
O2(g)═H2O(g)△H2
D . CaO(s)+H2O(l)═Ca(OH)2(s)△H1; CaCO3(s)═CaO(s)+CO2(g)△H2
①C (s)+O2(g)═CO2(g)△H1 C(s)+  O2(g)═CO(g)△H2
O2(g)═CO(g)△H2
②S(s)+O2(g)═SO2(g)△H1 S(g)+O2(g)═SO2(g)△H2
③H2(g)+  O2(g)═H2O(l)△H1 2H2(g)+O2(g)═2H2O(l)△H2
O2(g)═H2O(l)△H1 2H2(g)+O2(g)═2H2O(l)△H2
④CaO(s)+H2O(l)═Ca(OH)2(s)△H1CaCO3(s)═CaO(s)+CO2(g)△H2 .
 O2(g)=CO2(g);△H12CO(g)+O2(g)=2CO2(g);△H2
D . H2(g)+Cl2(g)=2HCl(g);△H1
O2(g)=CO2(g);△H12CO(g)+O2(g)=2CO2(g);△H2
D . H2(g)+Cl2(g)=2HCl(g);△H1  H2(g)+
H2(g)+  Cl2(g)=HCl(g);△H2
Cl2(g)=HCl(g);△H2
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ 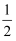 O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ 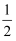 O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
 O2(g) = CO(g) ΔH=ΔH1-ΔH2
D . 化学反应的ΔH , 只与反应体系的始态和终态有关,与反应途径无关
O2(g) = CO(g) ΔH=ΔH1-ΔH2
D . 化学反应的ΔH , 只与反应体系的始态和终态有关,与反应途径无关
a. 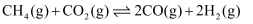 ∆H1
∆H1
b. 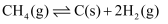 ∆H2
∆H2
c. 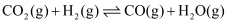 ∆H3
∆H3
d.  ∆H4
∆H4
e. 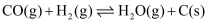 ∆H5
∆H5
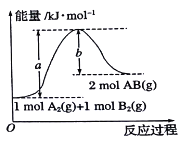
反应Ⅰ: ;
;
反应Ⅱ: 。
。
回答下列问题:
-
(1) 能否通过反应Ⅰ判断等物质的量的CO、
 具有能量的高低?(填“能”或“不能”)。
具有能量的高低?(填“能”或“不能”)。
-
(2) CO的燃烧热
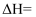
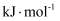 。
。
-
(3) 下列各图中表示反应Ⅱ能量变化的是____(填字母)。A .
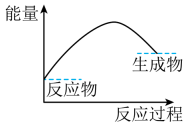 B .
B . 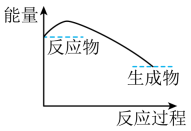 C .
C . 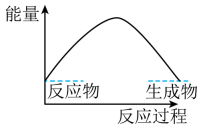 D .
D . 
-
(4)
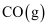 与
与 反应生成
反应生成 , 该反应的热化学方程式为。
, 该反应的热化学方程式为。
-
(5) 依据反应Ⅱ,
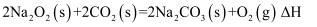 (填“>”“<”或“=”)
(填“>”“<”或“=”)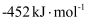 。
。



