反应热的大小比较 知识点题库
①C(s)+O2(g)═CO2(g)△H1; C(s)+ O2(g)═CO(g)△H2
O2(g)═CO(g)△H2
②2H2(g)+O2(g)═2H2O(g)△H1; 2H2(g)+O2(g)═2H2O(l)△H2
③H2(g)+Cl2(g)═2HCl(g)△H1;  H2(g)+
H2(g)+ l2(g)═HCl(g)△H2
l2(g)═HCl(g)△H2
④CaCO3(s)═CaO(s)+CO2(g)△H1; CaO(s)+H2O(l)═Ca(OH)2(s);△H2 .
3Fe2O3(s)+CO(g)→2Fe3O4(s)+CO2(g)+Q1 kJ;
Fe3O4(s)+CO(g)→3FeO(s)+CO2(g)+Q2 kJ;
FeO(s)+CO(g)→Fe(s)+CO2(g)+Q3 kJ.
则Q与Q1、Q2、Q2的关系式正确的是( )
 D .
D . 
 O2(g)=H2O(l);△H=+285.8 kJ•mol﹣1
D . 在稀溶液中:H+(aq)+OH﹣(aq)=H2O(l);△H=﹣57.3l kJ•mol﹣1 , 若将含0.5mol H2SO4的浓硫酸与1mol NaOH溶液混合,放出的热量大于57.31 kJ
O2(g)=H2O(l);△H=+285.8 kJ•mol﹣1
D . 在稀溶液中:H+(aq)+OH﹣(aq)=H2O(l);△H=﹣57.3l kJ•mol﹣1 , 若将含0.5mol H2SO4的浓硫酸与1mol NaOH溶液混合,放出的热量大于57.31 kJ
①H2( g )+  O2 ( g )=H2O ( g )△H1=a kJ/mol
O2 ( g )=H2O ( g )△H1=a kJ/mol
②2H2( g )+O2 ( g )=2H2O ( g )△H2=b kJ/mol
③H2( g )+  O2 ( g )=H2O ( l )△H3=c kJ/mol
O2 ( g )=H2O ( l )△H3=c kJ/mol
④2H2( g )+O2 ( g )=2H2O ( l )△H4=d kJ/mol
则a、b、c、d的关系正确的是( )
-
(1) S(s)+O2(g)=SO2(g) ΔH1
S(g)+O2(g)=SO2(g) ΔH2
ΔH1ΔH2
-
(2) CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
ΔH1ΔH2
-
(3) 4Al(s)+3O2(g)=2Al2O3(s) ΔH1
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH2
ΔH1ΔH2
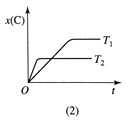
 pC(g),在不同温度T、压强p下,生成物C的物质的量分数x(C)的变化情况,如图所示。下列对该反应的判断正确的是( )
pC(g),在不同温度T、压强p下,生成物C的物质的量分数x(C)的变化情况,如图所示。下列对该反应的判断正确的是( )
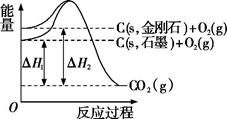
①C(s)+O2(g)=CO2(g)ΔH1;C(s)+O2(g)=CO(g)ΔH2
②S(s)+O2(g)=SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+1/2O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)=2H2O(l)ΔH6
④CaCO3(s)=CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)=Ca(OH)2(s)ΔH8
-
(1) 反应物能量总和(填“大于”、“小于”或“等于”)生成物能量总和.
-
(2) 若1mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量889.6kJ.(填“>”、“<”或“=”)
-
(3) 已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g)=2H2O(l)△H=﹣572kJ/mol,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是.
-
(4) 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.
①已知甲烷燃料电池的总反应式为CH4+2O2+2KOH═K2CO3+3H2O,通入甲烷的这个电极是(填“正极”或“负极”),其另外一电极上的电极反应式为:.
②通常情况下,甲烷燃料电池的能量利用率(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
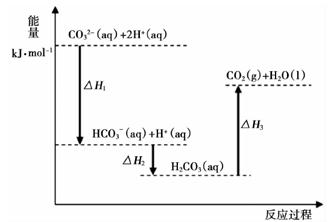
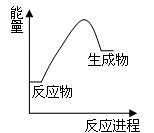 C . 化学键断裂放出能量
D . 反应物总能量与生成物总能量一定相等
C . 化学键断裂放出能量
D . 反应物总能量与生成物总能量一定相等

-
(1) Ⅰ.某实验小组对
 分解速率的影响因素做了如下探究:
分解速率的影响因素做了如下探究: 甲同学依据实验①和实验②所得数据进行处理得图1曲线,乙同学依据实验③和实验④所得数据进行处理得图2曲线。

由图1可知:该因素对过氧化氢分解速率的影响是。分析图2,可得出的结论是。
-
(2) 丙同学设计了几组实验,探究影响
 分解速率的其他因素,记录数据如表。已知表中“时间(s)”表示用20 mL
分解速率的其他因素,记录数据如表。已知表中“时间(s)”表示用20 mL  制取50 mL(常温常压下)
制取50 mL(常温常压下)  所需的时间。
所需的时间。 
15%

6%

3%

无催化剂、不加热
几乎不反应
几乎不反应
几乎不反应
无催化剂、加热
160
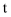
720
粉末(颗粒直径:100nm)
10
25
60
粉末(颗粒直径:1000nm)
30
70
190
推测时间t的范围为。实验结果表明,催化剂的催化效果与有关。
-
(3) Ⅱ.用如图所示装置进行中和反应反应热的测定实验,请回答下列问题:

从实验装置上看,图中尚缺少的一种仪器是。
-
(4) 取50 mL 0.5
 盐酸与50 mL 0.55
盐酸与50 mL 0.55  NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.0℃,已知中和后生成溶液的比热容
NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.0℃,已知中和后生成溶液的比热容  ,假设盐酸和NaOH溶液的密度都是1
,假设盐酸和NaOH溶液的密度都是1 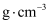 。计算该实验测得的中和热
。计算该实验测得的中和热 
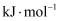 。
。
-
(5) 现将一定量的稀盐酸、稀硝酸、稀醋酸分别和1 L 1
 稀NaOH溶液恰好完全反应,其反应热分别为
稀NaOH溶液恰好完全反应,其反应热分别为  、
、  、
、  ,则
,则  、
、  、
、  的大小关系为。
的大小关系为。



